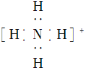题目内容
【题目】(1)①为了纪念元素周期表诞生150周年,联合国将2019年定为“国际化学元素周期表年”。Fe在元素周期表中的位置为__________。科学家在研究金属矿物质组分的过程中。发现了Cu-Ni-Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体的方法是_____________。
②已知:r(Fe2+)为61 pm,r(Co2+)为65 pm。在隔绝空气条件下分别加热FeCO3和CoCO3,实验测得FeCO3的分解温度低于CoCO3,原因是_______。
③下表是Fe和Cu的部分电离能数据,请解释I2(Cu)大于I2(Fe)的主要原因是__。
元素 | Fe | Cu |
第一电离能I1/kJ·mol-1 | 759 | 746 |
第一电离能I2/kJ·mol-1 | 1561 | 1958 |
(2)原子序数依次增大的五种元素A、B、C、D、E分别处于第一至第四周期,A是前四周期中原子半径最小的元素,B原子核外电子有6种不同的运动状态,常温下C的单质是空气中含量最多的成份,D最高价氧化物对应水化物的酸性最强,E的基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
①B2A2的电子式是___,D所在主族的前四种元素分别与A形成的化合物,其共价键的极性由强到弱的顺序是___(填化学式)。
②A和C形成的简单化合物遇到D单质出现白烟现象,写出有关反应的化学方程式为____。
③向E的硫酸盐溶液中滴加过量氨水,观察到的现象是首先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,请写出最后-步得到深蓝色透明溶液对应的离子方程式____。
(3)金属镓有“电子工业脊梁“的美誉,镓及其化合物应用广泛。砷化镓是半导体材料属立方晶系,其晶胞结构如图所示。
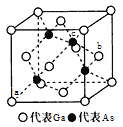
①晶胞中,与Ga原子等距离且最近的As原子形成的空间构型为____。
②原子坐标参数是晶胞的基本要素之-,表示晶胞内部各原子的相对位置,图中a(0,0,0)、b(1,![]() ,
,![]() ),则c原子的坐标参数为_____。
),则c原子的坐标参数为_____。
【答案】第四周期Ⅷ族 X射线衍射 Fe2+的半径小于Co2+,FeO的晶格能大于CoO,FeCO3比CoCO3易分解 失去第二个电子时,Cu失去的是全充满3d10电子,Fe失去的是4s1电子 ![]() HF >HCI> HBr >HI 8NH3+3Cl2===N2+6NH4Cl Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2+4H2O+2OH- 正四面体结构 (
HF >HCI> HBr >HI 8NH3+3Cl2===N2+6NH4Cl Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2+4H2O+2OH- 正四面体结构 (![]() ,
,![]() ,
,![]() )
)
【解析】
原子序数依次增大的五种元素A、B、C、D、E分别处于第一至第四周期,A是前四周期中原子半径最小的元素,A是H,B原子核外电子有6种不同的运动状态,B是C。常温下C的单质是空气中含量最多的成份,C是O。D最高价氧化物对应水化物的酸性最强,D是Cl。E的基态原子的最外能层只有一个电子,其他能层均已充满电子,E是Cu。
(1)①Fe在元素周期表中第四周期Ⅷ族,区分晶体和非晶体方法是X射线衍射;
②FeCO3的分解温度低于CoCO3原因是:Fe2+的半径小于Co2+,FeO的晶格能大于CoO,FeCO3比CoCO3易分解;
③结合表中数据I2(Cu)大于I2(Fe)分析,失去第二个电子时,Cu失去的是全充满3d10电子,Fe失去的是4s1电子。所以I2(Cu)大于I2(Fe);
(2)①![]() Cl所在主族的前四种元素分别与H形成的化合物,其共价键的极性由强到弱的顺序是HF >HCI> HBr >HI;
Cl所在主族的前四种元素分别与H形成的化合物,其共价键的极性由强到弱的顺序是HF >HCI> HBr >HI;
②8NH3+3Cl2===N2+6NH4Cl;
③Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2+ 4H2O+2OH-;
(3)①晶胞中,与Ga原子等距离且最近的As原子形成的空间构型为正四面体结构;
②图中a(0,0,0)、b(1,![]() ,
,![]() ),则c原子的坐标参数为(
),则c原子的坐标参数为(![]() ,
,![]() ,
,![]() )。
)。