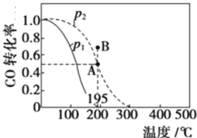
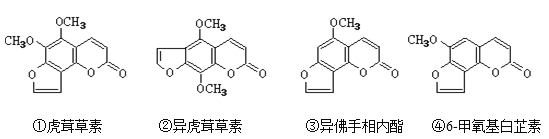
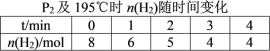题目内容
【题目】设NA为阿伏加德罗常数值,下列有关叙述正确的是()
A.将78gNa2O2与过量CO2反应转移的电子数为2NA
B.1molN2与4molH2反应生成的NH3分子数为2NA
C.标准状况下,2.24LSO3中所含原子数为0.4NA
D.标准状况下,18gD2O中所含电子数为9NA
【答案】D
【解析】
A.78gNa2O2是1mol,与过量CO2反应中Na2O2既是氧化剂又是还原剂,属于歧化反应,所以转移的电子数为NA,故A错误;
B.因为N2+3H2![]() 2NH3为可逆反应,所以1molN2与4molH2反应生成的NH3分子数小于2NA,故B错误;
2NH3为可逆反应,所以1molN2与4molH2反应生成的NH3分子数小于2NA,故B错误;
C.标准状况下, SO3不是气体,所以无法计算SO3中所含原子数,故C错误;
D.标准状况下,18gD2O是0.9mol,含有的电子数=0.9mol ![]() 10
10![]() NA= 9NA,故D正确;
NA= 9NA,故D正确;
所以答案:D。

 名校课堂系列答案
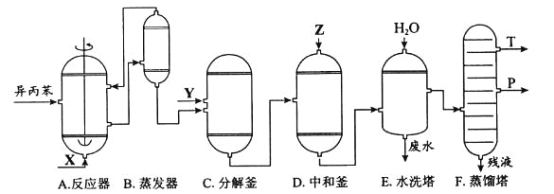
名校课堂系列答案【题目】苯酚和丙酮都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下:
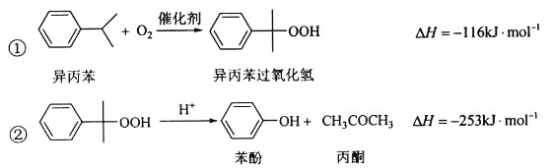
相关化合物的物理常数:
物质 | 相对分子质量 | 密度(g/cm-3) | 沸点/℃ |
异丙苯 | 120 | 0.8640 | 153 |
丙酮 | 58 | 0.7898 | 56.5 |
苯酚 | 94 | 1.0722 | 182 |
回答下列问题:
(1)在反应器A中通入的X是_______。
(2)反应①和②分别在装置_______和________中进行(填装置符号)。
(3)在分解釜C中加入的Y为少量浓硫酸,其作用是_____,优点是用量少,缺点是__________。
(4)反应②为_____(填“放热”或“吸热”)反应。反应温度控制在50-60℃,温度过高的安全隐患是_____。
(5)中和釜D中加入的Z最适宜的是__________(填编号)
a.NaOH b.CaCO3c.NaHCO3d.CaO
(6)蒸馏塔F中的馏出物T和P分别为_______和________,判断的依据是______。
(7)用该方法合成苯酚和丙酮的优点是____________。
【题目】干燥剂的干燥性能可用干燥干燥效率(1立方米空气中实际余留水蒸气的质量![]() 来衡量
来衡量![]() 某些干燥剂的干燥效率如下:
某些干燥剂的干燥效率如下:
物质 | MgO | CaO | ZnCl2 | ZnBr2 |
干燥效率 | 0.008 | 0.2 | 0.8 | 1.1 |
根据以上数据,有关叙述错误的是
A. MgO的干燥性能比CaO差 B. 干燥效率可能与干燥剂的阴阳离子半径大小有关
C. MgCl2可能是比CaCl2更好的干燥剂 D. 上述干燥剂中阳离子对干燥性能的影响比阴离子大
【题目】在2L恒容密闭容器中投入足量M(s)和一定量的R(g),发生反应为M(s)+R(g)![]() X(g)+Y(g) △H;所得实验数据如表所示:
X(g)+Y(g) △H;所得实验数据如表所示:
实验 | 温度/℃ | 起始时R的物质的量/mol | 平衡时气体总物质的量/mol |
① | 300 | 2.00 | 2.80 |
② | 400 | 2.00 | 3.00 |
③ | 400 | 4.00 | a |
下列推断正确的是( )
A.上述反应中,△H<0
B.实验②中,该反应的平衡常数K=0.5
C.实验①经4min达到平衡,0~4 min内υ(X)=0.2mol·L-1·min-1
D.实验③中a=6.00