题目内容
【题目】从樟科植物枝叶提取的精油中含有甲、乙两种成分:
![]()
![]()
(1)①用酸性高锰酸钾溶液检验甲和乙中含有碳碳双键,方案是否可行 填“可行”或“不可行”)。
②请写出甲的一种能同时满足下列3个条件的同分异构体的结构简式 。
a.苯环上有两个不同的取代基
b.能与Br2的CCl4溶液发生加成反应
c.遇FeCl3溶液呈现紫色
(2)由甲转化为乙的过程为(已略去无关产物):
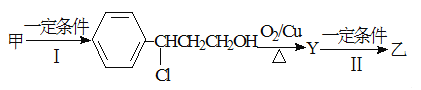
步骤Ⅰ的反应类型为 ,Y的结构简式 ,设计步骤Ⅰ的目的是 。
(3)1 mol乙最多可与 mol H2发生加成反应。
(4)写出乙与新制Cu(OH)2悬浊液反应的化学方程式 。
【答案】(1)①不可行
②![]() (或其他合理答案)
(或其他合理答案)
(2)加成反应;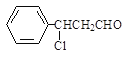 ;保护碳碳双键,防止被氧化
;保护碳碳双键,防止被氧化
(3)5
(4)![]() +Na
+Na![]()
![]() +Cu2O↓+3H2O
+Cu2O↓+3H2O
【解析】试题分析:(1)①甲中的醇羟基和乙中的醛基均能使酸性高锰酸钾溶液褪色,所以用酸性高锰酸钾溶液检验甲和乙中含有碳碳双键不可行。②甲的同分异构体,a.苯环上有两个不同的取代基;b.能与Br2的CCl4溶液发生加成反应,说明结构中有碳碳双键,c.遇FeCl3溶液呈现紫色,说明有酚羟基,则可以是![]() 或写成邻位或间位的取代基都可以。
或写成邻位或间位的取代基都可以。
(2)步骤1是双键变单键的过程,所以该反应为加成反应;R-CH2OH能在铜作催化剂、加热的条件下与氧气反应生成醛,则Y是![]() ,因为在氧化羟基到醛基的过程中,碳碳双键也容易被氧化,所以设计步骤1的目的是保护碳碳双键,防止被氧化。
,因为在氧化羟基到醛基的过程中,碳碳双键也容易被氧化,所以设计步骤1的目的是保护碳碳双键,防止被氧化。
(3)乙中有1个苯环和1个碳碳双键和1个醛基,它们都可以和氢气发生加成反应,所以1摩尔乙需要5摩尔氢气。
(4)乙中有醛基,能与氢氧化铜反应生成羧基,反应的化学方程式为:
![]() +Na
+Na![]()
![]() +Cu2O↓+3H2O。
+Cu2O↓+3H2O。

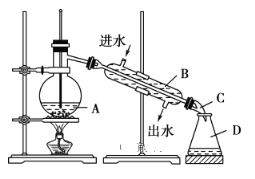
【题目】葡萄酒中抗氧化剂的残留量是以游离SO2的含量计算,我国国家标准(GB2760-2014)规定葡萄酒中SO2的残留量≤0.25g/L。某兴趣小组用下图装置(夹持装置略)收集某葡萄酒中的SO2,并对含量进行测定。实验步骤如下
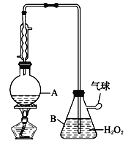
i. 检查装置的气密性后,向仪器A中加入300.00ml葡萄酒和适量盐酸
ii. 加热使SO2全部逸出并与B中H2O2完全反应
iii. 除去B中过量的H2O2后,将B中溶液取出,稀释至100mL
iv.取25.00mL 稀释后的溶液至于锥形瓶中,加入几滴酚酞
v.用0.0300mol/L NaOH标准溶液进行滴定,重复三次
(1)SO2在水中可形成SO2 ─饱和H2SO3溶液体系,此体系中存在多个含硫元素的平衡,分别用化学方程式表示为_______________。
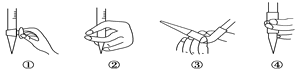
(2)图中①中仪器名称为_____________,步骤v中,滴定前排气泡时,应选择图中的___。
(3)除去过量H2O2的方法是_________________。
(4)滴定的终点现象_____________________________________;若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积 (填序号)___________(①=10 mL,②=40 mL,③<10 mL,④>40 mL)。
(5)滴定消耗的NaOH溶液的体积如下,则该葡萄酒中SO2含量为____g/L。
滴定次数 | 1 | 2 | 3 |
NaOH溶液体积/mL | 21.80 | 20.02 | 19.98 |
(6)某同学认为该测定结果不能说明该葡萄酒中SO2残留量一定超标。原因是__________。利用现有装置可以如何改进?_____________。