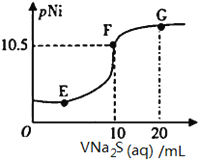
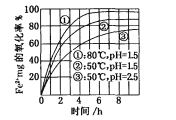
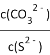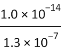题目内容
【题目】下列反应原子利用率最高的是
A. 工业制漂白粉2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
B. 工业制备钠2NaCl(熔融)![]() 2Na+Cl2↑
2Na+Cl2↑
C. 火法炼铜3Cu2S+3O2![]() 6Cu+3SO2
6Cu+3SO2
D. 现代石油工业采用银做催化剂生产环氧乙烷2CH2=CH2→![]()
【答案】D
【解析】
化学反应中原子的利用率最高,则反应物全部转化为生成物,且生成物一般一种,常见反应类型有化合反应、加成、加聚反应等。
A、工业制漂白粉 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,生成物有3种,原子利用率不高,故A错误;
B、工业制备钠2NaCl=2Na+Cl2↑,生成物有2种,原子利用率不高,故B错误;
C、火法炼铜Cu2S+O2=2Cu+SO2生成物有2种,原子利用率不高,故C错误;
D、为化合反应,生成物只有一种,离子利用率最高,故D正确。
故选D。

【题目】下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ |
(1)在这些元素中,化学性质最不活泼的是:_______(填具体元素符号或化学式,下同)。
(2) 在最高价氧化物的水化物中,酸性最强的化合物的子式是_________,第三周期中碱性最强的化合物的化学式是____________________。
(3)最高价氧化物是两性氧化物的元素是____________;写出它最高价氧化物对应水化物与氢氧化钠反应的化学方程式_______________________________________。
(4)用电子式表示元素④与⑥形成化合物的形成过程:________________________,该化合物属于__________________(填 “共价”或“离子”)化合物。
(5)表示③与①最高价态形成的化合物电子式___________________,该化合物分子由___________(填“极性”“非极性”)键形成。
【题目】在2 L固定容积的密闭容器中,800 ℃时发生反应2NO(g)+O2(g)![]() 2NO2(g)。该体系中,n(NO)随时间的变化如下表:
2NO2(g)。该体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.012 | 0.009 | 0.008 | 0.0075 | 0.0075 |

反应过程如上图所示,a、b、c、d其中只有3条曲线是正确的。请回答:
(1)图中表示NO2的变化的曲线是________,A点时,v(正)______v(逆) (填“大于”“小于”或“等于”,下同)。用O2表示从0~3 s内该反应的平均速率v=____________。
(2)能说明该反应已经达到平衡状态的是________ (填字母)。
a.混合气体的平均摩尔质量不变 b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内的密度保持不变
e.相同时间内,每消耗2a mol的NO同时生成等量的NO2
f.混合气体中O2和NO2物质的量之比为1∶2的状态
(3)已知上述反应为放热反应,达平衡后改变条件继续进行。在t1~t6内反应速率与时间图像如图,在每一时刻均只改变一个影响反应速率的因素,则下列说法正确的是__________。

A.在t1时增大了压强 B.在t3时加入了催化剂
C.在t4时降低了温度 D.t0~t1时X的转化率最高
(4)能使该反应的反应速率增大的是________(填字母)。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂