题目内容
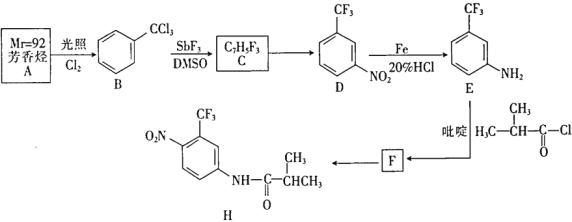
【题目】已知:pNi=-lgc(Ni2+);常温下,K(NiCO3)=1.4×10-7,H2S的电离平衡常数:Ka1=1.3×10-7,Ka2=7.1×10-15。常温下,向10mL0.1mol·L-1Ni(NO3)2溶液中滴加0.1mol·L-1Na2S溶液,滴加过程中pNi与Na2S溶液体积的关系如图所示。下列说法不正确的是( )。
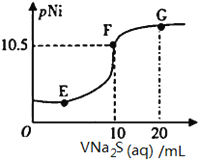
A. E、F、G三点中,F点对应溶液中水电离程度最小
B. 常温下,Ksp(NiS)=1×10-21
C. 在NiS和NiCO3的浊液中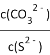 =1.4×1014
=1.4×1014
D. Na2S溶液中,S2-第一步水解常数Kh1=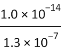
【答案】D
【解析】
硝酸镍是强酸弱碱盐,硫化钠是强碱弱酸盐,它们都能促进水的电离。F点表示硝酸镍和硫化钠恰好完全反应,溶液中溶质是硝酸钠,据此分析A的正误;根据NiS(s) ![]() Ni2+(aq)+S2-(aq),Ksp(NiS)=c(Ni2+)c(S2-)分析B的正误;根据NiCO3(s)+S2-(aq)
Ni2+(aq)+S2-(aq),Ksp(NiS)=c(Ni2+)c(S2-)分析B的正误;根据NiCO3(s)+S2-(aq) ![]() NiS(s)+CO32-(aq) K=
NiS(s)+CO32-(aq) K=![]() 分析C的正误;根据S2-+H2O
分析C的正误;根据S2-+H2O![]() HS-+OH-,Kh1=
HS-+OH-,Kh1=![]() 分析D的正误。
分析D的正误。
A.硝酸镍是强酸弱碱盐,硫化钠是强碱弱酸盐,它们都能促进水的电离。F点表示硝酸镍和硫化钠恰好完全反应,溶液中溶质是硝酸钠,水的电离程度最小,故A正确;B.NiS(s) ![]() Ni2+(aq)+S2-(aq),Ksp(NiS)=c(Ni2+)c(S2-)=1×10-21,故B正确;C.NiCO3(s)+S2-(aq)
Ni2+(aq)+S2-(aq),Ksp(NiS)=c(Ni2+)c(S2-)=1×10-21,故B正确;C.NiCO3(s)+S2-(aq) ![]() NiS(s)+CO32-(aq) K=
NiS(s)+CO32-(aq) K=![]() =
=![]() =1.4×1014,故C正确;D.S2-+H2O
=1.4×1014,故C正确;D.S2-+H2O![]() HS-+OH-,Kh1=
HS-+OH-,Kh1=![]() =
=![]() ,故D错误;故选D。
,故D错误;故选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】二氯化二硫(S2Cl2)在工业上用于橡胶的硫化。为在实验室合成S2Cl2,某化学研究性学习小组查阅了有关资料,得到如下信息:
①将干燥纯净的氯气在110℃~140℃与硫反应,即可得S2Cl2粗品。
②有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
S | 112.8 | 444.6 | 略 |
S2Cl2 | -77 | 137 | 与过量氯气发生S2Cl2+Cl2 |
设计实验装置图如下:

(1)仪器A的名称是______________。
B中反应的离子方程式为_________________________________。
(2) S2Cl2遇水会生成黄色单质、一种能使品红溶液褪色的气体化合物及酸雾,D中的试剂应是________,写出该反应的化学方程式__________________ 。
(3)装置H的作用是_______________ ,其中发生反应的化学方程式为 ______________________。
(4)S2Cl2粗品中可能混有的杂质是SCl2、Cl2、S,为了提高S2Cl2的纯度,关键的操作是控制好温度和_______。