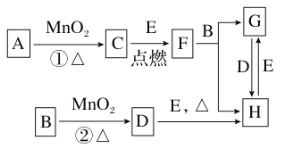
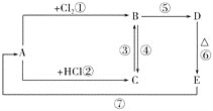
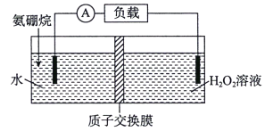
题目内容
【题目】某实验小组用0.5mol/L NaOH溶液和0.5mol/L硫酸溶液进行中和热的测定。
Ⅰ.准备仪器
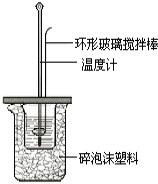
(1)环形玻璃搅拌棒__________(填“能”或“不能”)改为环形金属(如铜)棒,其原因是__________。
(2)碎泡沫的作用是______________,终止温度应为反应的最________(填“高”或“终”)温度。
II.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
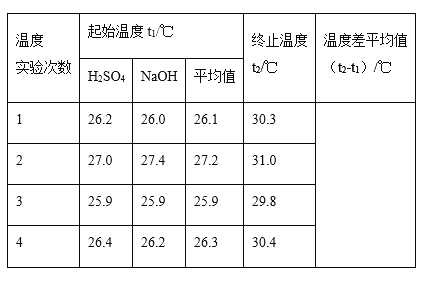
(1)四次实验所得到的温度平均值为__________℃。
(2)取50mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如表。
①近似认为0.5mol/LNaOH溶液和0.5mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J·g-1·℃-1。则中和热△H =_____(取小数点后一位)。
②上述实验数值结果与573KJ·mol-1有偏差,产生偏差的原因可能是(填字母)_____。
a.实验装置保温、隔热效果差
b. 量取NaOH溶液的体积时仰视读数
c. 分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.反应时未用搅拌器搅拌
【答案】不能 金属导热性强,散失热量多,实验误差大 保温,防止热量散失 高 4.07 53.5 acd
【解析】
Ⅰ.(1)铜是热的良导体,易损失热量,实验误差大,所以不能将环形玻璃搅拌棒改为环形铜棒;
(2)因为该实验中要尽可能的减少热量的损失,所以大小烧杯间填满碎泡沫塑料的作用减少实验过程中的热量损失;
终止温度应为反应的最高温度,才能测得放热的最大量;
II.(1)①第一次测定温度差为:(30.3-26.1)℃=4.2℃,第二次测定的温度差为:(31.0-27.2)℃=3.8℃,第三次测定的温度差为:(29.8-25.9)℃=3.9℃,第四次测定的温度差为:(30.4-26.3)℃=4.1℃,实验2的误差太大要舍去,三次温度差的平均值为4.07℃;
②50mL0.50mol/L氢氧化钠与30mL0.50mol/L硫酸溶液进行中和反应,生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为:80mL×1g/mL=80g,温度变化的值为△T=4.0℃,则生成0.025mol水放出的热量为:Q=mc△T=80g×4.18J/(g℃)×4.0℃=1337.6J,即1.3376kJ,所以实验测得的中和热△H=![]() =-53.5kJ/mol;
=-53.5kJ/mol;
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,选项a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,选项b错误;
c.分多次把NaOH 溶液倒人盛有硫酸的小烧杯中,热量散失较多,测得温度偏低,中和热的数值偏小,选项c正确;
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,导致温度计上残留的碱液与稀硫酸反应,起始温度偏高,测量值偏小,选项d正确。
答案选acd。

 同步奥数系列答案
同步奥数系列答案【题目】有关元素X、Y、D、E的信息如下:
元素 | 有关信息 |
X | 地壳中含量最高的元素 |
Y | 第三周期中原子半径最小的元素 |
D | 最高价氧化物既能溶于强酸又能溶于强碱 |
E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
用化学用语回答下列问题:
(1)D在元素周期表中的位置为____。
(2)X、Y、D形成的简单离子的半径由大到小为_____。
(3)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为_________,D的单质溶于强碱的离子方程式为________。
(4)E元素与Y元素可形成EY2和EY3两种化合物,下列说法正确的是(填序号)_____。
①保存EY2溶液时,需向溶液加入少量E单质
②EY2、EY3均能通过化合反应生成
③向煮沸的NaOH溶液中滴加几滴饱和EY3溶液,可以制得胶体