题目内容
19.X、Y、Z、W四种元素在元素周期表中序数逐渐增大.X为非金属元素,且X、W同主族,Y、Z为同周期的相邻元素.W原子的质子数等于Y、Z原子最外层电子数之和.Y的氢化物与其最高价氧化物的水化物可以发生反应.Z原子最外层电子数是次外层电子数的3倍.试推断:(1)X、Y、Z、W的元素符号分别是:H、N、O、Na.
(2)画出Z的离子结构示意图
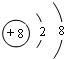 .
.(3)X和W 这两种元素与Z都能形成A2B、A2B2型化合物,W的A2B2型化合物的电子式是
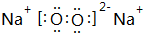 ,X的A2B2型化合物的结构式是H-O-O-H.
,X的A2B2型化合物的结构式是H-O-O-H.(4)有X、Y、Z所形成的离子化合物是硝酸铵(填名称),它与W的最高价氧化物对应水化物的溶液加热时反应的离子方程式是NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
分析 X、Y、Z、W四种元素在元素周期表中序数逐渐增大.Z原子最外层电子数是次外层电子数的3倍,则Z有2个电子层,最外层电子数为6,故Z为氧元素;Y、Z为同周期的相邻元素,Y的氢化物与其最高价氧化物的水化物可以发生反应,则Y为氮元素;W原子的质子数等于Y、Z原子最外层电子数之和,则W的质子数为5+6=11,则W为钠元素;X为非金属元素,且X、W同主族,则X为氢元素,据此解答.
解答 解:X、Y、Z、W四种元素在元素周期表中序数逐渐增大.Z原子最外层电子数是次外层电子数的3倍,则Z有2个电子层,最外层电子数为6,故Z为氧元素;Y、Z为同周期的相邻元素,Y的氢化物与其最高价氧化物的水化物可以发生反应,则Y为氮元素;W原子的质子数等于Y、Z原子最外层电子数之和,则W的质子数为5+6=11,则W为钠元素;X为非金属元素,且X、W同主族,则X为氢元素.
(1)由上述分析可知,X为H,Y为N,Z为O,W为Na,故答案为:H、N、O;Na;
(2)Z的离子为O2-,离子结构示意图为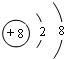 ,故答案为:
,故答案为: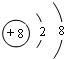 ;
;
(4)W与Z形成的A2B2型化合物化合物为Na2O2,电子式是 ,X与Z形成的A2B2型化合物为H2O2,结构式是H-O-O-H,故答案为:
,X与Z形成的A2B2型化合物为H2O2,结构式是H-O-O-H,故答案为: ;H-O-O-H;
;H-O-O-H;
(3)X为氢元素,Y为氮元素,Z为氧元素,三元素组成的离子化合物为NH4NO3,名称是硝酸铵,与氢氧化钠溶液在加热条件反应离子方程式为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,
故答案为:硝酸铵;NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
点评 本题考查结构性质位置关系,难度不大,元素Z的推断为突破口,注意基础知识的理解掌握.

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化情况如图所示.则下列说法中不正确的是( )
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化情况如图所示.则下列说法中不正确的是( )| A. | 还原性:I->Fe2+>Br- | |
| B. | 原混合溶液中FeBr2的物质的量为3mol | |
| C. | 线段AB表示Fe2+被氯气氧化 | |
| D. | 原溶液中:n(Fe2+):n(I-):n(Br-)═2:1:3 |
| A. | 4种 3种 | B. | 4种 2种 | C. | 3种 3种 | D. | 3种 2种 |
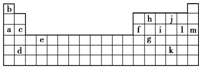 下表是元素周期表的一部分.下表中所列的字母分别代表某一种元素.
下表是元素周期表的一部分.下表中所列的字母分别代表某一种元素.(1)下列①④(填写编号)组元素的单质可能都是电的良导体.
①a、c、h ②b、g、k③c、h、l ④d、e、f
(2)下列由a~g形成的各分子中所有原子都满足最外层为8电子结构的是AB.
A.ib3 B.hl4 C.il5 D.hb4
(3)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去.核外电子离开该原子所需的能量主要受两大因素的影响:a.原子核对核外电子的吸引力b.形成稳定结构的倾向.下表是一些气态原子失去核外不同电子所需的能量(kJ•mol-1)
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
②用电子式(相应元素符号)表示化合物X2j2的形成过程
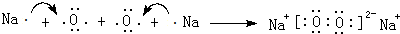 .
.③Y是周期表中的ⅢA族元素.以上13种元素中,Ar元素原子(填写元素符号)失去核外第一个电子需要的能量最多.
| A. | 增大亚硫酸钠粉末的量 | |
| B. | 硫酸浓度增大一倍,用量减少到原来的$\frac{1}{2}$ | |
| C. | 硫酸浓度不变,用量增大一倍 | |
| D. | 使反应在较低温度下进行 |
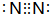 ;用电子式表示D2A的形成过程
;用电子式表示D2A的形成过程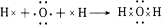 .
.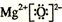 .
. 2014 年10 月7 日,赤崎勇、天野浩和中村修二因发明“高亮度蓝色发光二极管(LED)”获得2014 年诺贝尔物理学奖.制作LED 首先在衬底上制作氮化镓(GaN)基的外延片,常用的衬底主要有蓝宝石(Al2O3)、碳化硅和硅,还有砷化镓(GaAs)、AlN、ZnO 等材料.回答下列问题:
2014 年10 月7 日,赤崎勇、天野浩和中村修二因发明“高亮度蓝色发光二极管(LED)”获得2014 年诺贝尔物理学奖.制作LED 首先在衬底上制作氮化镓(GaN)基的外延片,常用的衬底主要有蓝宝石(Al2O3)、碳化硅和硅,还有砷化镓(GaAs)、AlN、ZnO 等材料.回答下列问题: