题目内容
【题目】2mol金属钠和1mol氯气反应的能量关系如图所示,下列说法不正确的是( )
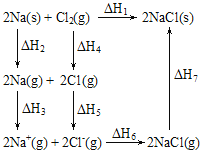
A.ΔH1=ΔH2+ΔH3+ΔH4+ΔH5+ΔH6+ΔH7
B.ΔH4的值数值上和Cl-Cl共价键的键能相等
C.ΔH7<0,且该过程形成了分子间作用力
D.ΔH5<0,在相同条件下,2Br(g)的ΔH5′>ΔH5
【答案】C
【解析】
A.由盖斯定律可得,ΔH1=ΔH2+ΔH3+ΔH4+ΔH5+ΔH6+ΔH7,A正确;
B.ΔH4为破坏1molCl-Cl共价键所需的能量,与形成1molCl-Cl共价键的键能在数值上相等,B正确;
C.物质由气态转化为固态,放热,则ΔH7<0,且该过程形成了离子键,C不正确;
D.Cl转化为Cl-,获得电子而放热,则ΔH5<0,在相同条件下,由于溴的非金属性比氯弱,得电子放出的能量比氯少,所以2Br(g)的ΔH5′>ΔH5,D正确;
故选C。

练习册系列答案
相关题目