题目内容
【题目】燃煤及工业废气中的SO2是形成酸雨的主要原因,消除SO2是减少酸雨形成的有效方法。完成下列问题:
(1)已知:4FeS2(s)+11O2(g)═2Fe2O3(s)+8SO2(g)△H=﹣3412.0kJmol﹣1
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=﹣25.0 kJmol﹣1
2C(s)+O2(g)═2CO(g)△H=﹣221.0 kJmol﹣1
则2FeS2(s)+7O2(g)+3C(s)═2Fe(s)+3CO2(g)+4SO2(g)△H=_____kJmol﹣1。
(2)碱性NaClO2溶液脱硫法
SO2与碱性NaClO2溶液反应的离子方程式为2SO2+ClO2﹣+4OH﹣2SO42﹣+C1﹣+2H2O,已知pc=﹣lgc(SO2)。在刚性容器中,将含SO2的废气通入碱性NaClO2溶液中,测得pc与温度的关系如图所示。
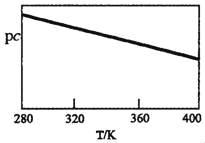
由图分析可知,该脱硫反应是_____反应(填“放热”或“吸热”);若温度不变,增大压强,该脱硫反应的平衡常数K_____(填“增大”、“减小”或“不变”)。
(3)燃料细菌脱硫法
①含FeS2的燃煤可用氧化亚铁硫杆菌(T.f)、氧化亚铁微螺菌(L.f)、氧化硫硫杆菌(T.t)进行脱硫,其脱硫过程如图所示:
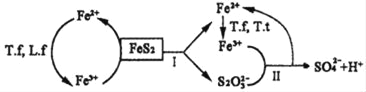
已知:脱硫总反应为:FeS2+14Fe3++8H2O═2SO42﹣+15Fe2++16H+,
Ⅰ反应的化学方程式为:FeS2+6Fe3++3H2O═S2O32﹣+7Fe2++6H+;
写出Ⅱ反应的化学方程式_____。
②在上述脱硫反应中,氧化亚铁硫杆菌(T.f)与Fe3+的形成过程可视为下图所示的原电池:

该细胞膜为_____(填“阳离子交换膜”或“阴离子交换膜”)。该电池的正极电极反应式为_____。该方法在高温下脱硫效率大大降低,原因是_____。
【答案】﹣2062.5 放热 不变 8Fe3++S2O32﹣+5H2O═2SO42﹣+8Fe2++10H+ 阳离子交换膜 O2+4H++4e﹣=2H2O 温度过高蛋白质发生变性,细菌失去催化能力 。
【解析】
(1)盖斯定律计算,利用同向相加、异向相减的原则;
(2)由图分析可知,升温平衡向吸热方向移动可知,对于平衡常数,如果是放热反应,随着温度上升,平衡常数减小;如果是吸热反应,随着温度上升,平衡常数上升;温度不变,K不变;
(3)①观察图像可知:反应Ⅱ是Fe3+和S2O32﹣反应生成亚铁离子和硫酸根离子,利用得失电子数相等、电荷守恒、原子守恒写出离子方程式;
②在脱硫反应中,氧化亚铁硫杆菌(T.f)与Fe3+的形成过程为如图所示的原电池反应,亚铁离子被氧化发生氧化反应在原电池负极反应,正极是氧气在酸性溶液中生成水,正极消耗氢离子,确定细胞膜为阳离子交换膜;温度过高蛋白质发生变性,细菌失去催化能力;
(1)已知:①4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g)△H=﹣3412.0kJmol﹣1
②Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=﹣25.0 kJmol﹣1
③2C(s)+O2(g)=2CO(g)△H=﹣221.0 kJmol﹣1
盖斯定律①×1/2+②+③×3/2计算 2FeS2(s)+7O2(g)+3C(s)=2Fe(s)+3CO2(g)+4SO2(g)△H=﹣2062.5KJ/mol;
答案:﹣2062.5。
(2)已知pc=﹣lgc(SO2),pc与温度的关系分析,温度越高Pc越小,则二氧化硫浓度增大,逆反应为吸热反应,正反应为放热反应,平衡常数只随温度变化,若温度不变,增大压强,该脱硫反应的平衡常数K不变;
答案:放热;不变。
(3)①反应Ⅱ是Fe3+和S2O32﹣反应生成亚铁离子和硫酸根离子,反应的离子方程式:8Fe3++S2O32﹣+5H2O═2SO42﹣+8Fe2++10H+;
答案:8Fe3++S2O32﹣+5H2O═2SO42﹣+8Fe2++10H+。
②脱硫反应中,氧化亚铁硫杆菌(T.f)与Fe3+的形成过程为如图所示的原电池反应,亚铁离子被氧化发生氧化反应在原电池负极反应,正极是氧气在酸性溶液中生成水,电极反应:O2+4H++4e﹣=2H2O,正极消耗氢离子,该细胞膜为阳离子交换膜,该方法在高温下脱硫效率大大降低,原因是:温度过高蛋白质发生变性,细菌失去催化能力;
答案:阳离子交换膜;O2+4H++4e﹣=2H2O;温度过高蛋白质发生变性,细菌失去催化能力。

 阅读快车系列答案
阅读快车系列答案