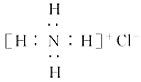题目内容
【题目】现有下列反应:
①2H2O+Cl2+SO2=H2SO4+2HCl
②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
针对上述两个反应回答:
(1)用单线桥标出①中电子转移的方向和数目_______________________________;
(2)写出②的离子化学方程式_____________________________________________;
(3)Cl2、H2SO4和KMnO4的氧化性由强到弱的顺序为________________________;
(4)反应②中氯化氢表现出的性质是________。
a.还原性 b.酸性 c.氧化性
【答案】![]() 2MnO
2MnO![]() +16H++10Cl
+16H++10Cl![]() =2Mn2++5Cl2↑+8H2O KMnO4 >Cl2> H2SO4 ab
=2Mn2++5Cl2↑+8H2O KMnO4 >Cl2> H2SO4 ab
【解析】
(1)根据氧化还原反应中元素化合价升降及得失电子数目进行分析;
(2)根据离子反应方程式的书写原则进行书写;
(3)根据氧化还原反应中氧化剂的氧化性强于氧化产物进行判断;
(4)根据HCl中Cl元素化合价部分升高,部分不变进行分析。
(1)该反应中,Cl元素化合价由0价变为-1价、S元素化合价由+4价变为+6价,所以Cl2是氧化剂、SO2是还原剂,其转移电子数是2,单线桥转移电子数目和方向为![]() ;
;
(2)反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中KMnO4、KCl、MnCl2均为可溶性盐必须拆成离子,HCl为强电解质,也拆成离子,故反应的离子方程式为2MnO![]() +16H++10Cl
+16H++10Cl![]() =2Mn2++5Cl2↑+8H2O;
=2Mn2++5Cl2↑+8H2O;
(3)反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中KMnO4做氧化剂,氧化HCl得到氧化产物Cl2,氧化性KMnO4>Cl2;
反应2H2O+Cl2+SO2=H2SO4+2HCl中Cl2做氧化剂,氧化SO2得到氧化产物H2SO4,氧化性Cl2>H2SO4;
故Cl2、H2SO4和KMnO4的氧化性由强到弱的顺序为KMnO4 >Cl2> H2SO4;
(4)反应②中HCl中Cl元素化合价升高,反应物HCl是还原剂,具有还原性,Cl元素被氧化,对应产物Cl2是氧化产物,盐酸中的Cl有部分转化为化合价不变的氯化钾中去,也体现了盐酸的酸性,答案选ab。

【题目】在温度相同、容积均为2 L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下。下列说法正确的是
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1mo N2、3mol H2 | 2mol N2、6mol H2 | 2mol NH3 |
NH3浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | 放出Q1kJ | 放出Q2kJ | 吸收Q3kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
A. 2p1=2p3<p2 B. 达到平衡时丙容器中NH3的体积分数最大
C. α2+α3<1 D. Q1+Q3=92.4