题目内容
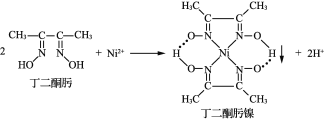
【题目】Ni2+与丁二酮肟生成鲜红色丁二酮肟镍沉淀,该反应可用于检验Ni2+。
(1)Ni2+基态核外电子排布式为___________。
(2)1mol丁二酮肟分子中含有σ键的数目为______mol。
(3)丁二酮肟镍分子中碳原子的杂化轨道类型为_____。
(4)Ni(CO)4是一种无色液体,沸点为43℃,熔点为-19.3 ℃。Ni(CO)4的晶体类型是____。
(5)与CO互为等电子体的二价阴离子为_____,Ni(CO)4中Ni与CO的C原子形成配位键,不考虑空间构型,Ni(CO)4的结构可用示意图表示为_____。
(6)下列离子的VSEPR模型与离子的空间立体构型一致的是_______。
A.SO32- B.ClO4- C.NO2- D.ClO3-
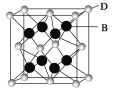
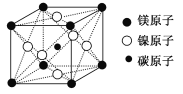
(7)最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该新型超导晶体的一个晶胞如图所示,则该晶体的化学式为______
【答案】1s22s22p63s23p63d8或[Ar]3d8 15 sp2、sp3 分子晶体 C![]()
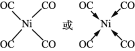 B MgCNi3
B MgCNi3
【解析】
(1)镍原子核外电子数是28,镍原子失去最外层2个电子变成基态Ni2+,根据构造原理书写基态Ni2+的核外电子排布式;
(2)单键中含有一个σ键,双键含有一个σ键和一个π键;
(3)根据价层电子对互斥理论确定中心原子杂化方式;
(4)分子晶体的熔沸点较低;
(5)价电子数相等、原子个数相等的微粒为等电子体;Ni(CO)4中Ni与CO的C原子形成配位键,形成四面体结构。
(6) 价层电子对互斥模型(简称VSEPR模型),根据价电子对互斥理论,价层电子对个数=σ键个数+孤电子对个数;σ键个数=配原子个数,孤电子对个数=![]() (a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数;分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子;实际空间构型要去掉孤电子对,略去孤电子对就是该分子的空间构型;
(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数;分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子;实际空间构型要去掉孤电子对,略去孤电子对就是该分子的空间构型;
(7)利用均摊法确定晶胞的化学式,位于顶点上的一个原子被8个晶胞占有,位于面心上的原子被2个晶胞占有,位于体心上的一个原子被一个晶胞占有,据此计算晶胞的化学式。
(1)镍原子核外电子数是28,镍原子失去最外层2个电子变成基态Ni2+,根据构造原理知,基态Ni2+的核外电子排布式为1s22s22p63s23p63d8(或[Ar]3d8);
(2)已知丁二酮肟的结构式为![]() ,分子中含有13个单键,和2个双键,则共含有15个σ键,所以1mol丁二酮肟含有σ键数目为15mol;
,分子中含有13个单键,和2个双键,则共含有15个σ键,所以1mol丁二酮肟含有σ键数目为15mol;
(3)甲基上碳原子价层电子对个数是4且不含孤电子对,为sp3杂化,连接甲基的碳原子含有3个价层电子对且不含孤电子对,为sp2杂化;
(4)Ni(CO)4是一种无色液体,沸点为43℃,熔点为-19.3 ℃。可见Ni(CO)4的晶体熔沸点较低,因为分子晶体的熔沸点较低,所以该物质的晶体类型为分子晶体;
(5)价电子数相等,原子个数相等的微粒为等电子体,故与CO互为等电子体的二价阴离子为C22-,Ni(CO)4中Ni与CO的C原子形成配位键,形成四面体结构,其结构图为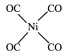 或
或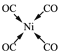 ;
;
(6)A.SO32-中价层电子对个数=3+![]() (6+2-3×2)=4且中心S原子上含有一个孤电子对,所以VSEPR模型为四面体结构,离子的空间立体构型为三角锥形结构,A错误;
(6+2-3×2)=4且中心S原子上含有一个孤电子对,所以VSEPR模型为四面体结构,离子的空间立体构型为三角锥形结构,A错误;
B.ClO4-中价层电子对个数=4+![]() (7+1-4×2)=4,且中心Cl原子且不含孤电子对,所以离子的VSEPR模型与离子的空间立体构型一致都是平面三角形结构,B正确;
(7+1-4×2)=4,且中心Cl原子且不含孤电子对,所以离子的VSEPR模型与离子的空间立体构型一致都是平面三角形结构,B正确;
C.NO2-中价层电子对个数=2+![]() ×(5+1-2×2)=3,且中心N原子上含有一个孤电子对,所以其VSEPR模型是平面三角形,实际上是V形,C错误;
×(5+1-2×2)=3,且中心N原子上含有一个孤电子对,所以其VSEPR模型是平面三角形,实际上是V形,C错误;
D.ClO3-中价层电子对个数=3+![]() ×(7+1-3×2)=4,且中心Cl原子上含有一个孤电子对,所以VSEPR模型是四面体结构,实际空间构型为三角锥形,D错误;
×(7+1-3×2)=4,且中心Cl原子上含有一个孤电子对,所以VSEPR模型是四面体结构,实际空间构型为三角锥形,D错误;
故合理选项是B。
(7)碳原子位于该晶胞的体心上,所以该晶胞中含有一个C原子;镁原子个数=8×![]() =1,则在该晶胞含有1个Mg原子;Ni原子个数=6×
=1,则在该晶胞含有1个Mg原子;Ni原子个数=6×![]() =3,在该晶胞中含有3个Ni原子,所以该晶胞的化学式为MgCNi3。
=3,在该晶胞中含有3个Ni原子,所以该晶胞的化学式为MgCNi3。

 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案【题目】有A、B、C、D、E五种元素。其相关信息如下:
元素 | 相关信息 |
A | A原子的1s轨道上只有1个电子 |
B | B是电负性最大的元素 |
C | C的基态原子2p轨道中有三个未成对电子 |
D | D是主族元素且与E同周期,其最外能层上有两个运动状态不同的电子 |
E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
请回答下列问题:
(1)写出E元素原子基态时的电子排布式_______。
(2)C元素的第一电离能比氧元素的第一电离能_____(填“大”或“小”)。
(3)CA3分子中C原子的杂化轨道类型是______,CA3分子的空间构型是_____。
(5)A、C、E三种元素可形成[E(CA3)4]2+配离子,其中存在的化学键类型有________(填序号)。
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
(5)B与D可形成离子化合物,其晶胞结构如图所示。其中D离子的配位数为_______。