题目内容
亚硝酸盐是一祌常见的食品添加剂,使用时必须严格控制其用量。为检测某食品中亚硝酸盐含量(通常以1kg样品中含NaNO2的质量计),某研究小组设计了如下两种实验方案:
(1)无色气体B遇空气显红棕色,B的化学式为_______写出甲方案①中反应的离子方程式_______
(2)完成并配平乙方案①中反应的离子方程式
MnO4-+ NO2-+ = Mn2++ NO3-+ ,
(3)乙方案②中需配置100mL0.0010mol/L(NH4)2Fe(SO4)2标准溶液,在已准确称量样品的质量后,还需要的仪器有:量筒、烧杯、_______配制溶液时,定容的操作方法是______
(4)若取样品ag,按乙方案进行测定,准确量取12.00mL0.0005mol/L的酸性高锰酸钾溶液(过童)与溶液A反应。反应后溶液用0.0010mol/L(NH4)2Fe(SO4)2标准溶液滴定至紫色溶液刚好褪去;重复上述实验2次,平均消耗(NH4)2Fe(SO4)2溶液10.00mL.则1kg样品中NaNO2的质量为_______mg.
(14分)
(1)NO (1分), 2I- +2NO2-+4H+ =I2+ 2NO↑+2H2O(2分)
(2)2MnO4-+ 5NO2-+ 6 H+ =" 2" Mn2+ + 5NO3-+ 3H2O (2分)
(3)玻璃棒、100mL容量瓶、胶头滴管,3分)
向容量瓶中注入蒸馏水,当液面离容量瓶颈刻度线下1~2厘米时,改用胶头滴管滴加
蒸馏水至液面与刻度线相切。(3分)
(4)690/a (3分)
解析试题分析:工艺流程的解题的关键,搞清楚加入了什么物质,发生什么反应(氧化还原反应居多),如何分离等。方案甲和乙分别为氧化还原反应,甲方案用到亚硝酸根的氧化性,方案乙用到亚硝酸根的还原性,两方程式分别为,甲:2I- +2NO2-+4H+ =I2+ 2NO↑+2H2O;乙:2MnO4-+ 5NO2-+ 6 H+ =" 2" Mn2+ + 5NO3-+ 3H2O;然后甲用Na2S2O3滴定I2,乙用(NH4)2Fe(SO4)2滴定过量高锰酸钾;根据滴定的量可以计算。(4)5Fe2+~MnO4-;n(MnO4-)= ×0.0010×0.01=2×10-6mol,乙方案中消耗的高锰酸钾为0.012L×0.0005mol/L-2×10-6mol=4×10-6mol;n(NaNO2)=
×0.0010×0.01=2×10-6mol,乙方案中消耗的高锰酸钾为0.012L×0.0005mol/L-2×10-6mol=4×10-6mol;n(NaNO2)=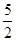 ×4×10-6mol=10-5mol,故每kg中含有690/amg。
×4×10-6mol=10-5mol,故每kg中含有690/amg。
考点:本题以工艺流程为基础,考查了元素及化合物知识、氧化还原反应、实验基本操作以及化学计算等相关知识。

(1)下列实验操作或对实验事实的描述不正确的有 (填序号)。
| A.用托盘天平称量17.55g氯化钠晶体 |
| B.碳酸钠溶液保存在带玻璃塞的试剂瓶 |
| C.用干燥的pH试纸测定新制氯水的pH |
| D.使用容量瓶配制溶液时,俯视刻度线定容后浓度偏大 |
F.除去CO2气体中混有的少量HCl,可以将气体通入饱和碳酸氢钠溶液
(2)下图为中学化学实验中常见的实验装置
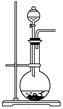


A B C
实验室常用装置A制备下表中气体,请将分液漏斗和圆底烧瓶中应装的化学试剂填写完整。
| 气体 | O2 | Cl2 | NH3 |
| 分液漏斗中试剂 | | | 浓氨水 |
| 圆底烧瓶中试剂 | | KMnO4 | |
可用B装置排液收集气体,气体应从该装置________(填“左”“右”)管口导进,倘若利用该装置收集Cl2,试剂瓶中盛放的试剂为 。
C装置用于处理多余气体对环境的污染,若利用该装置吸收Cl2,此时烧杯中发生反应的离子方程式为 。倘若该装置中仅仅盛放稀硫酸,通常不适合吸收氨气的原因是 ,若向烧杯中额外再加入一种液态有机物则可安全吸收氨气,这种有机物为 。
某研究性学习小组对用酸化的硝酸银溶液检验I-存在的合理性产生了兴趣,同学们根据变量控制思想进行如下方案设计并进行了实验探究:
[提出假设]
假设1:生成的AgI不溶于水,不能被HNO3氧化。
假设2:HNO3有氧化性,能将I-氧化成I2。
[设计实验方案,验证假设]
(1)甲同学向KI溶液中滴加硝酸化的AgNO3溶液并振荡,有黄色沉淀生成。验证了假设1成立。请写出有关化学方程式 。
(2)乙同学设计实验验证2,请帮他完成下表中内容。
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| | 若溶液变蓝,假设2成立。 若溶液不变蓝,假设2不成立。 |
| …… |
[结论与解释]
(3)甲同学验证了假设1成立,若乙同学验证了假设2成立,则丙同学由此得出的结论:硝酸酸化的AgNO3可以使I-沉淀,也能氧化I-。你同意丙同学的结论吗,并简述理由: 。
[思考与交流]
(3)研究性学习小组同学还想研究Fe3+能否氧化I-的问题,请你用两种方案来进行实验验证:
方案一:
方案二:
假设验证成立,请写出主要离子方程式 。
某同学进行实验研究时,欲配1.0mol?L-1Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2·8H2O试剂(化学式量:315)。在室温下配制溶液时发现所取试剂在足量的水中仅部分溶解,烧杯中存在大量未溶物。为探究原因,该同学查得Ba(OH)2·8H2O在283K、293K和303K时的溶解度(g/100g H2O)分别为2.5、3.9和5.6。
(1)烧杯中未溶物可能仅为BaCO3,理由是___________________________________。
(2)假设试剂由大量Ba(OH)2·8H2O和少量BaCO3组成,设计实验方案,进行成分检验。在答题纸上进一步完成实验步骤、预期现象和结论。(不考虑结晶水的检验;室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
| 实验步骤 | 预期现象和结论 |
 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀。 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀。 | |
| 步骤2:取适量滤液于试管中,滴加稀硫酸。 | |
| 步骤3:取适量步骤1中的沉淀于试管中,_____。 | |
| 步骤4: | |
将试剂初步提纯后,准确测定其中Ba(OH)2·8H2O的含量。实验如下:
(3)配制250ml 约0.1mol?L-1Ba(OH)2溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水,__________,将溶液转入_____________,洗涤,定容,摇匀。
(4)滴定:准确量取25.00ml所配制Ba(OH)2溶液于锥形瓶中,滴加指示剂,将__________(填“0.020”、“0.05”、“0.1980”或“1.5”)mol?L-1盐酸装入50ml酸式滴定管,滴定至终点,记录数据。重复滴定2次。平均消耗盐酸Vml。 计算Ba(OH)2·8H2O的质量分数=__________________(只列出算式,不做运算)
(5)室温下,________(填“能”或“不能”) 配制1.0 mol?L-1Ba(OH)2溶液。
下列用水就能鉴别的一组物质是
| A.苯、己烷、四氯化碳 | B.苯、乙醇、四氯化碳 |
| C.硝基苯、乙醇、四氯化碳 | D.硝基苯、乙醇、乙酸 |
下述实验设计能够达到目的的是
| 编号 | 实验目的 | 实验设计 |
| A | 除去CO2中少量的SO2 | 将混合气体通过饱和Na2CO3溶液 |
| B | 除去Cu粉中混有的CuO | 向混合物中滴加适量稀硝酸 |
| C | 检验溶液中是否含有Fe2+ | 向溶液中滴入氯水后,再滴加KSCN溶液 |
| D | 证明H2CO3酸性比H2SiO3强 | 将CO2通入Na2SiO3溶液中 |
下列药品和装置合理且能完成相应实验的是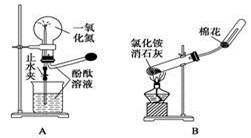
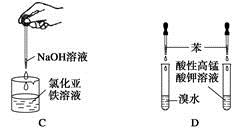
| A.喷泉实验 |
| B.实验室制取并收集氨气 |
| C.制备氢氧化亚铁 |
| D.验证苯中是否有碳碳双键 |
