题目内容
(1)玻璃棒是中学化学实验中常用的仪器。下列实验过程中,一般不需要用玻璃棒的是________(填写编号)。
①用pH试纸测定Na2CO3溶液的pH
②配制一定物质的量浓度的氯化钠溶液
③将适量氯化铁饱和溶液滴入沸水中制备氢氧化铁胶体
④探究Ba(OH)2·8H2O晶体和NH4Cl晶体反应过程中的能量变化
⑤实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
(2)用“大于”、“小于”或“等于”填空:
①读取量筒中液体的体积时,视线偏高,读取的体积数________实际体积数。
②用托盘天平称取10.4 g食盐,将砝码和食盐的位置颠倒,所称取食盐的质量_____10.4 g。
③配制500 mL 0.1 mol/L NaOH溶液,定容时俯视刻度线,所得溶液的物质的量浓度 _______0.1 mol/L。
④用中和滴定法测某NaOH溶液的浓度,量取待测液时未用该溶液润洗滴定管,测得的溶液浓度________实际浓度。
(1) ③⑤ (2)①大于 ②小于 ③大于 ④小于
解析试题分析:(1)玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流,根据各实验的实验目的确定是否需要玻璃棒。
(2)①根据量筒的读数从下到上数值逐渐增大,并根据俯视时的读数与液面的关系进行分析;
②根据天平的称量原理:左盘=右盘+游码的读数来分析;
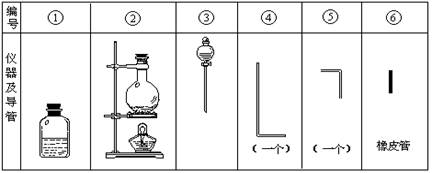
③根据俯视时的刻度线与液面的关系进行分析体积的大小,再根据c= 分析操作对溶质的物质的量或对溶液的体积的影响判断,如果n偏大或V偏小,则所配制溶液浓度偏高;
分析操作对溶质的物质的量或对溶液的体积的影响判断,如果n偏大或V偏小,则所配制溶液浓度偏高;
④根据量取待测液时末用该溶液润洗滴定管,待测液时浓度将变小,一定体积待测液中溶质的质量减小,消耗标准液的体积偏小,待测液的浓度偏小。
(1)①用pH试纸测定Na2CO3溶液的pH,用玻璃棒蘸取少许待测液于试纸的中部,故①错误;
②配制一定物质的量浓度的氯化钠溶液时,溶解需要玻璃棒搅拌,转移需要玻璃棒引流,故②错误;
③将适量氯化铁饱和溶液滴入沸水中制备氢氧化铁胶体,加热直到液体变为红褐色停止加热,无需玻璃棒搅拌,故③正确;
④探究Ba(OH)2?8H2O晶体和NH4Cl晶体反应过程中的能量变化,用玻璃棒搅拌两固体的混合物,故④错误;
⑤实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀,将吸有NaOH溶液的滴管插入液面以下,无需玻璃棒,故⑤正确,答案选③⑤。
(2)①因量筒的读数从下到上数值逐渐增大,俯视时的读数比液面高,所以读取的体积数大于实际体积数;
②因天平的称量原理:左盘=右盘+游码的读数,用托盘天平称取10.4g食盐,将砝码和食盐的位置颠倒,称得的质量为9.6g食盐;
③因俯视时的刻度线比液面高,溶液的体积偏小,浓度偏大;
④因量取待测液时末用该溶液润洗滴定管,所以待测液时浓度将变小,一定体积待测液中溶质的质量减小,消耗的标准液体积偏小,测得的溶液浓度小于实际浓度。
考点:考查化学实验基本操作、误差分析
点评:该题时高考中的常见题型,属于中等难度的试题,试题基础性强,侧重对学生基础知识的巩固和检验,有利于培养学生规范严谨的实验设计能力和动手操作能力。化学实验基本操作在平时的学习中注意积累和总结,并能灵活运用。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案某Na2CO3样品中混有一定量的Na2SO4 (设均不含结晶水),某化学兴趣小组采用两种方案测定该样品中Na2CO3的质量分数,试回答下列问题。
方案一:利用下列方案完成Na2CO3质量分数的測定
(1)操作③和④的名称分别为_______。
(2)上述操作①~④中,使用到玻璃棒的有______(填操作序号)。
(3)判断操作②否完成的方法是______
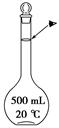
方案二:采用下图实验装置(夹持仪器已省略).选用下列试剂: a.浓硫酸b.饱和NaHCO3溶液C.6mol/L盐酸D.2mol/L硫酸, e.碱石灰f. 无水CaCl2,測定样品中Na2CO3,的质量分数:
(4)填写表中空格:
| 仪器 | 试剂 | 加入该试剂的目的 |
| A | | 鼓入空气时洗去CO2 |
| B | | 使样品充分反应放出气体 |
| C | a | |
| D | e | 充分吸收CO2 |
| E | e | |
下列有关实验装置进行的相应实验,能达到实验目的的是
图1 图2 图3 图4
| A.用图1所示装置除去Cl2中含有的少量HCl |
| B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
| C.用图3所示装置制取少量纯净的CO2气体 |
| D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层 |
下列有机物中含有的杂质(括号内为杂质),可用稀NaOH溶液作试剂并采用分液的方法除去的是
| A.苯(溴) | B.淀粉(葡萄糖) |
| C.甲苯(苯酚) | D.苯甲酸(苯酚) |

 ,如何检验含有Fe2+____________________________________。
,如何检验含有Fe2+____________________________________。 )如下:
)如下: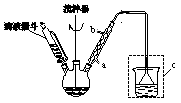
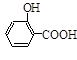 (水杨酸)+SOCl2→
(水杨酸)+SOCl2→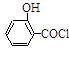 (水杨酰氯)+HCl↑+SO2↑
(水杨酰氯)+HCl↑+SO2↑  ],温度控制在100℃左右,不断搅拌。
],温度控制在100℃左右,不断搅拌。