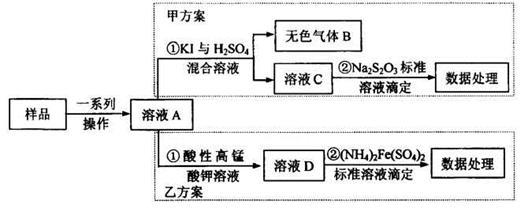
题目内容
过碳酸钠和盐酸反应的化学方程式为:2Na2CO4+4HCl=4NaCl+2CO2↑+O2↑+2H2O,商品过碳酸钠中一般都含有Na2CO3,为了测定它的纯度,取一定量的样品和盐酸反应,通过测量产生的氧气的体积,可以计算出过碳酸钠的含量。
(1)根据下图提供的仪器装置,组装一套测定商品过碳酸钠的实验装置,这些装置的连接顺序是(填接口字母): 。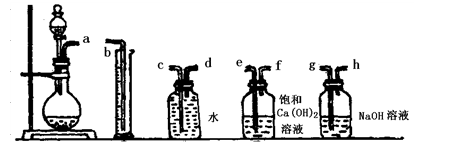
① ② ③ ④ ⑤
(2)装置④的作用是 。
(3)如果实验时,称取w g样品和过量盐酸反应后,测得氧气的体积(标准状况)为V mL,则此样品的纯度为 。
(9分)
(1) a→g,h→e,f→d,c→b
(2)检验CO2是否完全被吸收
(3)
解析试题分析:(1)过碳酸钠和碳酸钠均能与足量的盐酸反应,放出含有CO2和O2的气体,CO2对O2体积测量有干扰,因此利用排水量气法收集O2之前,需要除去CO2并确认CO2已经被完全除尽;图中几个装置的作用分别是制气、量液或O2的体积、排水集O2、确认是否含有CO2、除去CO2,除去并检验CO2时气体应该长进短出,排水集O2时应短进长出,因此这套装置的连接顺序为a→g,h→e,f→d,c→b;(2)、见(1);(3)、先由n=V/Vm求 n(O2),再由反应式2Na2CO4+4HCl=4NaCl+2CO2↑+O2↑+2H2O中过碳酸钠与氧气的化学计量数之比等于物质的量之比求 n(Na2CO4),然后再由m=n?M求m(Na2CO4),最后由过碳酸钠的质量和样品的质量求纯度。
考点:考查气体的实验室制取、净化、除杂、收集、量气等操作和原理、物质的量在化学方程式计算中的应用、物质纯度的测定实验等相关知识。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案下列实验操作与预期实验目的或结论均正确的是( )
| 选项 | 实验操作 | 预期实验目的或结论 |
| A | 室温下,用pH试纸测定浓度为0.1mol·L-1 Na2SiO3溶液和Na2CO3溶液的pH | 比较Si和C的电负性 |
| B | 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中含有SO42- |
| C | 向某溶液中加入2滴KSCN溶液,溶液不显红色。再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| D | 将某气体通入淀粉和KI的混合溶液,溶液变蓝色 | 该气体一定是Cl2 |
为提纯下列物质(括号内物质为杂质),所选用的试剂和分离方法正确的是
| | 物 质 | 除杂试剂 | 分离方法 |
| A | 硝酸铜溶液(硝酸银) | 铜粉 | 结晶 |
| B | NaCl溶液(CuCl2) | NaOH溶液 | 萃取 |
| C | 乙醇(水) | —— | 分液 |
| D | 镁粉(铝粉) | NaOH溶液 | 过滤 |

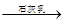 Mg(OH)2
Mg(OH)2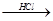 MgCl2溶液→MgCl2·6H2O→MgCl2
MgCl2溶液→MgCl2·6H2O→MgCl2 Mg
Mg

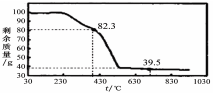

 NaHCO3↓+NH4Cl,请回答以下问题:
NaHCO3↓+NH4Cl,请回答以下问题:
 )如下:
)如下: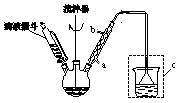
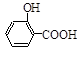 (水杨酸)+SOCl2→
(水杨酸)+SOCl2→ (水杨酰氯)+HCl↑+SO2↑
(水杨酰氯)+HCl↑+SO2↑  ],温度控制在100℃左右,不断搅拌。
],温度控制在100℃左右,不断搅拌。