题目内容
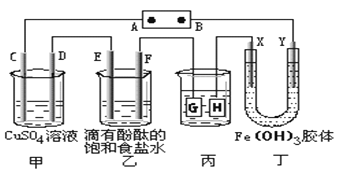
【题目】如图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极。
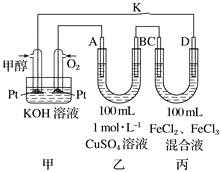
(1)写出甲池中负极电极反应式_________________________________________
(2)写出A电极的电极反应式____________________________________________
(3)写出丙中反应的离子方程式___________________________________________
(4)工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。则乙中A极析出的气体在标准状况下的体积为_____________________。
【答案】![]()
![]()
![]()
![]()
【解析】
(1)甲醇燃料电池是原电池反应,甲醇在负极失电子发生氧化反应,电极反应为:![]() ,故答案为:
,故答案为:![]()
(2)100mL1mol/L的硫酸铜溶液中含有铜离子0.1mol,硫酸根离子0.1mol,当电解硫酸铜溶液时,阳极反应式为:![]() ,故答案为:
,故答案为:![]() ;
;
(3)丙中反应的离子方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(4)工作一段时间后,断开K,此时A、B两极上产生的气体体积相同,分析电极反应,B为阴极,溶液中铜离子析出,氢离子得到电子生成氢气,设生成气体物质的量为X,溶液中铜离子物质的量为![]() ,电极反应为:
,电极反应为:
Cu2++2e-=Cu,2H++2e-=H2↑;
0.1mol 0.2mol 2x x
A电极为阳极,溶液中的氢氧根离子失电子生成氧气,电极反应为:
4OH--4e-=2H2O+O2↑;
4x x
得到0.2+2x=4x
x=0.1mol
乙中A极析出的气体是氧气物质的量为![]() ,在标准状况下的体积为
,在标准状况下的体积为![]() 故答案为:
故答案为:![]() 。
。

练习册系列答案
相关题目