题目内容
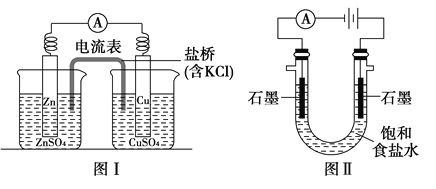
【题目】用新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不变化。常温下,MFe2Ox能使工业废气中的SO2转化为S,转化过程表示如图。下列说法正确的是 ( )
![]()
A.x﹥yB.SO2是该反应的催化剂
C.MFe2Ox是还原剂D.SO2发生了分解反应
【答案】C
【解析】
A.由题意可知SO2转化为S,S元素化合价降低,说明SO2在反应中为氧化剂,则MFe2Ox为还原剂,反应后Fe元素的化合价升高,根据化合价代数和为零,则有(2y-2)>(2x-2),即y>x,故A错误;
B.SO2在反应中转化为S,属于氧化剂,不是催化剂,故B错误;
C.由反应可知SO2转化为S,S元素化合价降低,说明SO2在反应中为氧化剂,则MFe2Ox为还原剂,故C选项是正确的;
D.该反应是SO2和MFe2Ox反应,该反应中S元素化合价降低,MFe2Ox中铁元素化合价升高,发生了氧化还原反应,所以不是SO2发生了分解反应,故D选项是错误的;
所以答案C选项是正确的。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案【题目】下表是25 ℃时某些弱酸的电离平衡常数。
化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
(1)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为_______________________________________。
(2)向0.1 mol·L-1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH)∶c(CH3COO-)=5∶9,此时溶液pH=________。
(3)向碳酸钠溶液中滴加少量氯水的离子方程式为_____________________。
(4)若0.1mol·L-1CH3COOH溶液与0.1mol·L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则c(Na+)-c(CH3COO-)=_______________mol·L-1(填精确计算结果)。
(5) 将CH3COOH溶液与大理石反应所产生的标况下44.8L气体全部通入到2L 1.5mol/L的NaOH溶液中充分反应,则溶液中所有离子的物质的量浓度由大到小的顺序为__________________________。