题目内容
如图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。已知:2KMnO4+16HCl=2KCl+5Cl2↑+2MnCl2+8H2O。对实验现象的“解释或结论”正确的是( )
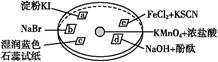

| 选项 | 实验现象 | 解释或结论 |
| A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
| B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
| C | d处立即褪色 | 氯气与水生成了漂白性物质 |
| D | e处变红色 | 还原性:Fe2+>Cl- |
D
a处变蓝,b处变红棕色,说明Cl2分别与KI、NaBr作用生成I2、Br2,可证明氧化性:Cl2>I2,Cl2>Br2,无法证明I2与Br2之间氧化性的强弱,A项错误;c处先变红,说明氯气与水生成酸性物质,后褪色,则证明氯气与水生成具有漂白性物质,B项错误;d处立即褪色,也可能是氯气与水生成酸性物质中和了NaOH,C项错误;e处变红说明Cl2将Fe2+氧化为Fe3+,证明还原性:Fe2+>Cl-,D项正确。

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
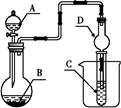
 淀粉溶液,则C中溶液变蓝
淀粉溶液,则C中溶液变蓝