题目内容
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。
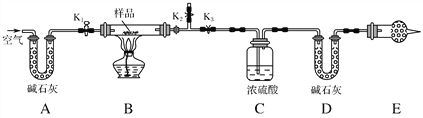
(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是_________。
②称取样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是________________。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为_________________________________________。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①若加热反应后不鼓入空气,对测定结果的影响是___________________。
②E处干燥管中盛放的药品是________,其作用是__________________ ________________,如果实验中没有该装置,则会导致测量结果NaHCO3的质量________(填“偏大”、“偏小”或“无影响”)。
③若样品质量为w g,反应后C、D装置增加的质量分别为m1 g、m2 g,则混合物中Na2CO3·10H2O的质量分数为________(用含w、m1、m2的代数式表示)。
【答案】 检查装置气密性 除去装置中的水蒸气和二氧化碳 2NaHCO3![]() Na2CO3+H2O↑+CO2↑ Na2CO3·10H2O
Na2CO3+H2O↑+CO2↑ Na2CO3·10H2O![]() Na2CO3+10H2O↑ Na2CO3·10H2O和NaHCO3的质量分数测定结果偏小,NaCl的质量分数测定结果偏大 碱石灰 防止空气中的CO2和水蒸气进入D中影响测定结果 偏大
Na2CO3+10H2O↑ Na2CO3·10H2O和NaHCO3的质量分数测定结果偏小,NaCl的质量分数测定结果偏大 碱石灰 防止空气中的CO2和水蒸气进入D中影响测定结果 偏大 ![]() ×100%
×100%
【解析】(1)①由实验原理可知,实验需要通过测量D装置内碱石灰的增重,计算生成的二氧化碳的质量,通过测量C装置装置,计算生成的水的质量,故应首先检验装置的气密性;
③装置内有空气,含有水蒸气和二氧化碳,影响水蒸气和二氧化碳质量的测定,打开活塞K1、K2,关闭活塞K3,实验前要通入空气,赶走装置中含有水蒸气和二氧化碳,减少误差;
④含NaCl、Na2CO310H2O和NaHCO3的混合物加热时,碳酸氢钠分解生成碳酸钠、二氧化碳和水,碳酸钠晶体失去结晶水生成碳酸钠,反应的化学方程式为:2NaHCO3![]() Na2CO3+H2O↑+CO2↑;Na2CO310H2O
Na2CO3+H2O↑+CO2↑;Na2CO310H2O![]() Na2CO3+10H2O↑;
Na2CO3+10H2O↑;
(2)①若加热反应后不鼓入空气,生成水蒸气质量和二氧化碳质量测定结果会减小,碳酸氢钠依据二氧化碳计算,而Na2CO310H2O的测定是根据生成水的总质量计算的,则测得Na2CO310H2O的含量将偏小对测定结果的影响是NaCl偏大,NaHCO3 偏小,Na2CO310H2O偏小;
②干燥管中盛放的是碱石灰,碱石灰能吸收空气中的水蒸气和二氧化碳,所以干燥管的作用是防止空气中的CO2和水蒸气进入影响测定结果,若撤去E装置,则测定的碳酸氢钠的质量偏大;
③D装置中增加的质量为二氧化碳的质量,碳酸氢钠分解生成的水蒸气的质量为x.
2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
18g 44g
xm2g
x=![]() g,
g,
装置C吸收的是水蒸气,包括碳酸氢钠分解生成的和十水碳酸钠分解生成的,十水碳酸钠分解生成的水蒸气的质量=m1g-![]() g=
g=![]() g.
g.
设十水碳酸钠的质量为y.
Na2CO310H2O![]() Na2CO3+10H2O
Na2CO3+10H2O
286g 180g

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
