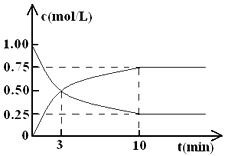
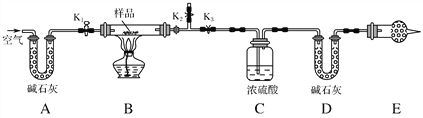
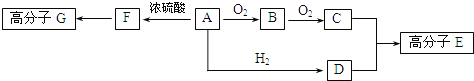
题目内容
【题目】已知反应: MnO2 +4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O。将一定质量的二氧化锰溶解在过量的浓盐酸中,反应一段时间后生成标准状况下氯气4.48 L (假设反应前后溶液体积不变)。试回答下列问题:
MnCl2 + Cl2↑+ 2H2O。将一定质量的二氧化锰溶解在过量的浓盐酸中,反应一段时间后生成标准状况下氯气4.48 L (假设反应前后溶液体积不变)。试回答下列问题:
(1)用单线桥法标明该反应中电子转移的方向和数目:______
MnO2 +4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
(2)计算反应消耗的MnO2的质量______ ;
(3)计算被氧化的HCl物质的量______ 。
【答案】 ![]() (浓)
(浓)![]() MnCl2 + Cl2↑+ 2H2O 17.4 g 0.4 mol
MnCl2 + Cl2↑+ 2H2O 17.4 g 0.4 mol
【解析】(1). 在MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O中,Mn元素的化合价从MnO2中的+4价降低到MnCl2中的+2价,得到2个电子,Cl元素的化合价从HCl中的-1价升高到Cl2中的0价,失去2个电子,则用单线桥法表示的式子为:
MnCl2+Cl2↑+2H2O中,Mn元素的化合价从MnO2中的+4价降低到MnCl2中的+2价,得到2个电子,Cl元素的化合价从HCl中的-1价升高到Cl2中的0价,失去2个电子,则用单线桥法表示的式子为:![]() (浓)
(浓)![]() MnCl2 + Cl2↑+ 2H2O。
MnCl2 + Cl2↑+ 2H2O。
(2). 生成标准状况下氯气4.48 L,则氯气的物质的量是:4.48L÷22.4L/mol=0.2mol,设反应消耗的MnO2的物质的量是xmol,则有:
MnO2+4HCl(浓)![]() MnCl2+ Cl2↑+ 2H2O
MnCl2+ Cl2↑+ 2H2O
1mol 1mol
xmol 0.2mol,得x = 0.2mol,则反应消耗的MnO2的质量是0.2mol×87g/mol = 17.4g,故答案是:17.4g。
(3). 设参加反应的HCl的物质的量是ymol,则有:
MnO2+4HCl(浓)![]() MnCl2+ Cl2↑+ 2H2O
MnCl2+ Cl2↑+ 2H2O
4mol 1mol
ymol 0.2mol,得y = 0.8mol,由反应方程式可知,被氧化的HCl是参加反应的HCl的一半,故被氧化的HCl的物质的量是0.8mol×![]() = 0.4mol,故答案是:0.4mol。
= 0.4mol,故答案是:0.4mol。