题目内容
【题目】用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(气体体积已折算为标准状况下的体积)。下列分析正确的是

A. OE段表示的平均速率最快
B. EF段,用盐酸表示该反应的平均反应速率为0.4mol/(L·min)
C. OE、EF、FG三段中,用二氧化碳表示该反应的平均反应速率之比为2:6:7
D. G点CO2不再增加的原因可能是盐酸的浓度过低
【答案】BD
【解析】本题考查化学反应速率和影响化学反应速率的因素。化学反应速率就是用单位时间内反应物或生成物的浓度的变化量来表示;影响化学反应因素的外因有:温度、压强、催化剂、浓度、固体反应物的表面积等。温度:在其它条件不变情况下,温度升高化学反应速率加快;反之,温度降低,化学反应的速率降低;催化剂:(正)催化剂加快化学反应的速率;浓度:在其它条件不变情况下,浓度增大化学反应速率增快,浓度减小化学反应速率减慢。
详解:A.斜率表示反应速率,斜率越大反应速率越大,由图可以知道,EF段斜率最大,所以EF段反应速率最大,故A错误;B、由图可以知道EF段生成的二氧化碳的体积为672ml-224ml=448ml,所以二氧化碳的物质的量为0.448L/22.4(L.mol-1)=0.02mol,根据CaCO3+2HCl=CaCl2+CO2+H2O,可以知道参加反应的氯化氢的物质的量为0.04mol,所以盐酸的浓度变化量为0.04mol /0.1L=0.4mol/L,所以EF段用盐酸表示该反应的平均反应速率为0.4(mol.L-1) /1min=0.04mol /(L·min-1),故B正确;C、OE、EF、FG三段生成的二氧化碳体积分别为224ml、448ml、112ml,所以OE、EF、FG三段中,该反应用CO2表示的平均反应速率之比为224ml:448ml:112ml =2:4:1,故C错误;D、G点表示收集的二氧化碳为从开始到G点生成的二氧化碳,总共784ml,可能是CaCO3反应完全,也可能是盐酸浓度太低了,故D正确;所以选项是BD。

【题目】实验室以绿矾(FeSO4·7H2O)制备补血剂甘氨酸亚铁[(NH2CH2COO)2Fe] 有关物质性质如下:
甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
实验过程:
Ⅰ.配制含0.10mol FeSO4的绿矾溶液。
Ⅱ.制备FeCO3:向配制好的绿矾溶液中,缓慢加入200mL 1.1mol·L-1NH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
Ⅲ.制备(NH2CH2COO)2Fe:实验装置如下图(夹持和加热仪器已省略),将实验Ⅱ得到的沉淀和含0.20 mol甘氨酸的水溶液混合后加入C中,然后利用A中的反应将C中空气排净,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。
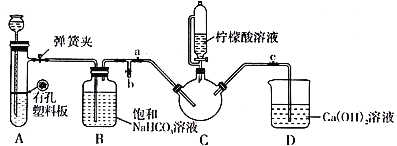
回答下列问题:
(1)实验I中:实验室配制绿矾溶液时,为防止FeSO4被氧化变质,应加入的试剂为_______(写化学式)。再滴加少量稀硫酸的作用是__________________________。
(2)实验II中:生成沉淀的离子方程式为__________________________。
(3)实验Ⅲ中:①C中盛柠檬酸溶液的仪器名称为___________________。
②装置A中所盛放的药品是___________________。(填序号)
A.Na2CO3和稀H2SO4 B.CaCO3和稀H2SO4 C.CaCO3和稀盐酸
③确认C中空气排尽的实验现象是____________________。
④加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是________________。
⑤洗涤实验Ⅲ中得到的沉淀,所选用的最佳洗涤试剂是___________________。(填序号)
A.热水 B.乙醇溶液 C.柠檬酸溶液
⑥若产品的质量为17.34g,则产率为________%。