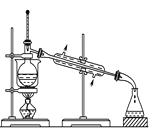
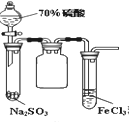
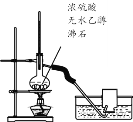
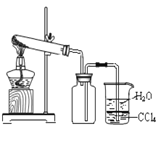
题目内容
【题目】近年来室内装修材料释放出的甲醛、苯、氨等有害气体严重影响人体健康,工业上利用氨气与甲醛(HCHO)的反应,不仅可消除污染,还可生产重要的工业原料六亚甲基四胺(结构如图所示,另一种产物是水)。下列有关说法错误的是
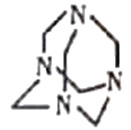
A.六亚甲基四胺的分子式为C6H12N4
B.六亚甲基四胺分子的摩尔质量为140 g·mol-1
C.参与反应的氨气与甲醛的物质的量之比为2:3
D.反应涉及的4种物质均为非电解质
【答案】D
【解析】
A. 由结构可知,六亚甲基四胺的分子式为C6H12N4,A项正确;
B. 六亚甲基四胺的分子式为C6H12N4,相对分子质量为140,摩尔质量数值上与相对分子质量相等,则摩尔质量为140 g·mol-1,B项正确;
C. 该反应的反应物为氨气与甲醛(HCHO),生成物为六亚甲基四胺和水,根据元素守恒知,每生成1mol六亚甲基四胺,需要4mol氨气和6mol甲醛(HCHO),则参与反应的氨气与甲醛的物质的量之比为2:3,C项正确;
D. 反应物为氨气与甲醛(HCHO),生成物为六亚甲基四胺和水,其中水为电解质,D项错误;
答案选D。

【题目】运用化学反应原理研究氮、硫单质及其化合物性质是一个重要的课题。回答下列问题:
(1)恒容密闭容器中,工业固氮:N2(g)+3H2(g) ![]() 2NH3(g)的平衡常数K值和温度关系如表:
2NH3(g)的平衡常数K值和温度关系如表:
温度/℃ | 25 | 200 | 300 | 400 | 450 |
K | 5108 | 1.0 | 0.86 | 0.507 | 0.152 |
①从上表列出数据分析,该反应为__________反应(填:“吸热”或“放热”)。
②有关工业合成氨的研究成果,曾于1918年、1931年、2007年三次荣膺诺贝尔奖。下列关于关于合成氨反应描述的图像中,不正确的是_________(填:字母选项)。
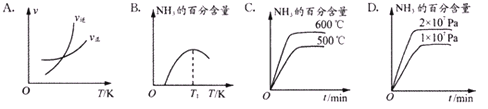
③450℃时,测得某时刻氨气、氮气、氢气物质的量浓度分别为3mol/L、2mol/L、1mol/L时,该反应的v(正)____________v(逆)(填“>”、“=”或“<”)。
(2)近年,科学家又提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)![]() 4NH3(g)+3O2(g),则其反应热ΔH=___________________。(已知:N2(g)+3H2(g)
4NH3(g)+3O2(g),则其反应热ΔH=___________________。(已知:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ·mol-1 2H2(g) +O2(g)
2NH3(g) △H=-92.4kJ·mol-1 2H2(g) +O2(g)![]() 2H2O(l) △H=-571.6kJ·mol-1 )
2H2O(l) △H=-571.6kJ·mol-1 )
(3)联氨(N2H4)、二氧化氮(NO2)可与KOH溶液构成碱性燃料电池,其电池反应原理为2N2H4 +2NO2 = 3N2+8H2O。则负极的电极反应式为__________________________。
(4)部分金属硫化物的溶度积常数(Ksp)如下表:
硫化物 | CuS | ZnS | MnS | FeS |
Ksp | 6.3×10-36 | 2.9×10-25 | 2.5×10-13 | 6.3×10-18 |
由列表数据分析推知,向含有Cu2+、Zn2+、Mn2+、Fe2+的工业废水中加入MnS粉末的作用是_____________________________________。
(5)工业上从废铅蓄电池废液回收铅的过程中,常用纯碱溶液与处理后的铅膏(主要含PbSO4)发生反应:PbSO4(s)+CO32-(aq)![]() PbCO3(s)+SO42-(aq)。已知溶度积常数:Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,则该反应的化学平衡常数K =_______。
PbCO3(s)+SO42-(aq)。已知溶度积常数:Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,则该反应的化学平衡常数K =_______。