题目内容
【题目】铝鞣剂主要成分为Al(OH)2Cl,主要用于揉制皮革。利用铝灰(主要成分为Al、Al2O3、AlN,FeO等)制备铝鞣剂的一种工艺如图所示:
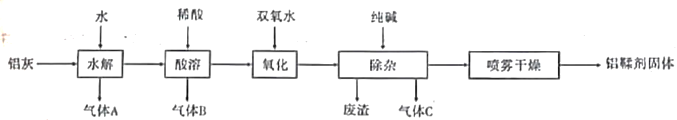
请回答下列问题:
(1)气体A、气体C的分子式为_________、______________
(2)产生气体B的化学方程式为:________________________________________________
(3)氧化时,发生反应的离子方程式为:__________________________________________
(4)废渣的主要成分为__________________(填化学式)。
(5)某同学设计如下方案测定铝鞣剂样品中Al(OH)2Cl质量分数。
操作Ⅰ:准确称取所制备的铝鞣剂m g放入烧杯中。
操作Ⅱ:加入_____________(填试剂名称),并用玻璃棒搅拌至固体全部溶解。
操作Ⅲ:加入足量___________(填化学式)溶液,充分反应,过滤、_________、__________得固体n g。根据所测数据即可计算出样品中Al(OH)2Cl质量分数。
【答案】NH3 CO2 2Al + 6HCl = 2AlCl3 + 3H2↑ 2Fe2+ + 2H+ + H2O2 = 2Fe3+ +2H2O Fe(OH)3 稀硝酸 AgNO3 洗涤 干燥
【解析】
铝灰主要成分为Al、Al2O3、AlN、FeO等,加水后,AlN发生水解反应生成氢氧化铝和NH3,为不引入杂质,酸溶时,应加入盐酸,加入盐酸酸溶后,生成氯化铝溶液和氯化亚铁溶液,其中铝与盐酸反应产生氢气,加入双氧水可氧化亚铁离子为铁离子,加入纯碱调节溶液pH使铁离子转化为氢氧化铁沉淀,则废渣为氢氧化铁,气体C为CO2,采用喷雾干燥制备铝鞣剂。
(5)为测定铝鞣剂样品中Al(OH)2Cl的质量分数,可以先测定其中氯离子物质的量,根据氯离子守恒计算Al(OH)2Cl的质量,进而计算样品中Al(OH)2Cl的质量分数,据此分析解答。
铝灰主要成分为Al、Al2O3、AlN、FeO等,加水后,AlN发生水解反应生成氢氧化铝和NH3,为不引入杂质,酸溶时,应加入盐酸,加入盐酸酸溶后,生成氯化铝溶液和氯化亚铁溶液,其中铝与盐酸反应产生氢气,加入双氧水可氧化亚铁离子为铁离子,加入纯碱调节溶液pH使铁离子转化为氢氧化铁沉淀,则废渣为氢氧化铁,气体C为CO2,采用喷雾干燥制备铝鞣剂。
(1)由以上分析知,气体A、气体C的分子式分别为NH3、CO2;
故答案为:NH3;CO2;
(2)酸溶时,加入的酸是盐酸,铝与盐酸生成氢气,B为氢气,反应的化学方程式为:2Al + 6HCl = 2AlCl3 + 3H2↑;
故答案为:2Al + 6HCl = 2AlCl3 + 3H2↑;
(3)酸溶后,生成氯化铝溶液和氯化亚铁溶液,加入双氧水可氧化亚铁离子为铁离子,则氧化时,发生反应的离子方程式为:2Fe2+ + 2H+ +H2O2 = 2Fe3+ +2H2O;
故答案为:2Fe2+ + 2H+ +H2O2 = 2Fe3+ +2H2O;
(4)由以上分析知,废渣的主要成分为Fe(OH)3;
故答案为:Fe(OH)3;
(5)为测定铝鞣剂样品中Al(OH)2Cl的质量分数,可以先测定其中氯离子物质的量,根据氯离子守恒计算Al(OH)2Cl的质量,进而计算样品中Al(OH)2Cl的质量分数,因此,操作Ⅱ:可加入硝酸溶解样品,操作Ⅲ:加入足量AgNO3溶液沉淀氯离子,充分反应,过滤、洗涤、干燥,得到固体n g。根据所测数据即可计算出样品中Al(OH)2Cl质量分数。
故答案为:稀硝酸;AgNO3;洗涤;干燥。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案