题目内容
19.某课外活动小组探究FeCl3溶液与Mg反应的实验:(1)甲同学将镁条放入FeCl3溶液中有大量气泡,且溶液慢慢变成红褐色,产生红褐色的原因是:镁与水解生成的氢离子反应生成氢气,促进了三价铁离子的水解,生成红褐色的Fe(OH)3溶液.当反应继续一段时间后,产生了红褐色沉淀,导致沉淀的原因是一是生成氢氧化铁量多,二是溶液中的氯化镁也增多,离子浓度增大,使红褐色的Fe(OH)3溶液聚沉生成红褐色Fe(OH)3沉淀.(回答两个要点)
(2)乙同学分析了溶液中的离子,依据2Fe3++Cu=2Fe2++Cu2+,你认为溶液中离子氧化性:Fe3+>H+(填>或<),他推测发生反应的离子方程式为2Fe3++Mg=2Fe2++Mg2+.
(3)丙同学为了证实乙同学分析的正确性,验证以上反应的存在(溶液还有Fe3+),该同学的实验操作和结论为取反应后的溶液少量于试管中,滴加KSCN溶液,如果不变血红色,说明反应存在,反之则没有存在.
分析 (1)将镁条放入FeCl3溶液中有大量气泡,说明镁与氢离子反应生成氢气,FeCl3溶液发生水解显酸性,根据平衡移动分析解答;
(2)依据2Fe3++Cu=2Fe2++Cu2+,得出离子氧化性:Fe3+>Cu2+,结合Cu2+的氧化性大于H+判断,根据氧化性H+大于镁离子书写发生反应的离子方程式;
(3)根据Fe3+与KSCN溶液变血红色检验判断.
解答 解:(1)因为FeCl3溶液发生水解显酸性,即Fe3++3H2O?2Fe(OH)3+3H+,所以将镁条放入FeCl3溶液中,镁与水解生成的氢离子反应生成氢气,则有大量气泡,正好促进了三价铁离子的水解,先是生成红褐色的Fe(OH)3溶液,反应继续一段时间后,一是生成氢氧化铁量多,二是溶液中的氯化镁也增多,离子浓度增大,使红褐色的Fe(OH)3溶液聚沉生成红褐色Fe(OH)3沉淀;故答案为:镁与水解生成的氢离子反应生成氢气,促进了三价铁离子的水解,生成红褐色的Fe(OH)3溶液;一是生成氢氧化铁量多,二是溶液中的氯化镁也增多,离子浓度增大,使红褐色的Fe(OH)3溶液聚沉生成红褐色Fe(OH)3沉淀;
(2)因为2Fe3++Cu=2Fe2++Cu2+,所以离子氧化性:Fe3+>Cu2+,又氧化性Cu2+>H+>Mg2+,则氧化性Fe3+>H+>Mg2+,可能发生反应的离子方程式为2Fe3++Mg=2Fe2++Mg2+,故答案为:>;2Fe3++Mg=2Fe2++Mg2+;
(3)因为Fe3+与KSCN溶液变血红色,所以验证以上反应的存在的实验操作和结论为取反应后的溶液少量于试管中,滴加KSCN溶液,如果不变血红色,说明反应存在,反之则没有存在,故答案为:取反应后的溶液少量于试管中,滴加KSCN溶液,如果不变血红色,说明反应存在,反之则没有存在.
点评 本题主要考查了实验中一些特殊现象的探究分析,难度不大,注意物质基本性质的把握.

 名校课堂系列答案
名校课堂系列答案| A. | 0.2 mol•L-1的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | 叠氮酸(HN3)与醋酸酸性相似,NaN3水溶液中离子浓度大小顺序为c(Na+)>c(N3-)>c(OH-)>c(H+) | |
| C. | 常温下向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中c(NH4+)=c(Cl-) | |
| D. | 常温下,等pH的CH3COONa、NaHCO3、NaClO三种溶液的浓度大小关系为c(NaClO)>c(NaHCO3)>c(CH3COONa) |
(1)实验室合成ClO2常用盐酸或双氧水还原氯酸钠(NaClO3).
①盐酸和NaClO3反应时有ClO2和Cl2生成,反应的离子方程式为2ClO3-+4H++2Cl-=2ClO2↑+Cl2↑+2H2O,当反应中转移0.2mol 电子时,参加反应的还原剂的物质的量为0.2mol.
②使用双氧水作还原剂的优点是使用双氧水作还原剂时氧化产物为氧气,对环境无污染.
(2)ClO2可用于合成亚氯酸钠(NaClO2).将ClO2通入NaOH溶液中,并加入适量双氧水,在稳定装置中充分反应可制得NaClO2成品. 已知:当pH≤2.0时,NaClO2能被I-完全还原成Cl-;二氧化氯(ClO2)是高效安全的饮用水消毒剂,得到越来越广泛的应用.回答下列问题:
溶液中Na2S2O3能与I2反应生成NaI和Na2S4O6.欲测定成品中NaClO2的含量,现进行如下操作:
| 步骤Ⅰ | 称取样品Wg配成溶液置于锥形瓶中,并调节PH≤2.0 |
| 步骤Ⅱ | 向锥形瓶中加入足量KI晶体,充分搅拌,并加入少量指示剂 |
| 步骤Ⅲ | 用c mol/L的Na2S2O3溶液滴定 |
②若上述滴定操作中平均消耗VmL Na2S2O3标准溶液,则成品中NaClO2的质量分数为$\frac{9.05×10{\;}^{-2}VC}{4W}$×100%(用含w、c、V的代数式表示).
(3)ClO2和Cl2均能将电镀废水中的CN-氧化为无毒的物质,自身被还原为Cl-.处理含相同量CN-的电镀废水,所需Cl2的物质的量是ClO2的2.5倍.
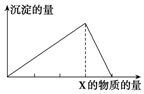 将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是( )
将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是( )| A | B | C | D | |
| X | CO2 | HCl | NaOH | AlCl3 |
| Y | Ca(OH)2 | AlO2- | AlCl3 | NaOH |
| A. | A | B. | B | C. | C | D. | D |
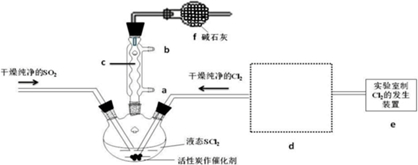
(1)仪器c的名称是球形冷凝管,装置f的作用是吸收逸出有毒的Cl2、SO2,防止空气中的水蒸气进入反应装置,防止SOCl2水解
(2)实验室制Cl2的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
(3)SOCl2与水反应的化学方程式为SOCl2+H2O=SO2↑+2HCl↑蒸干AlCl3溶液不能得到无水AlCl3,使SOCl2与AlCl3•6H2O混合加热,可得到无水AlCl3,试解释原因:AlCl3溶液易水解,AlCl3•6H2O与SOCl2混合加热,SOCl2与AlCl3•6H2O中的结晶水作用,生成无水AlCl3及SO2和HCl气体,SOCl2吸水,产物SO2和HCl抑制AlCl3水解
(4)下列四种制备SO2的方案中最佳选择是丁
| 方案 | 甲 | 乙 | 丙 | 丁 |
| 发生装置 |  |  | 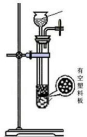 |  |
| 所选试剂 | NaHSO3固体 | 18.4mol/LH2SO4+Cu | 4mol/LHNO3+Na2SO3 | 70%H2SO4+K2SO3 |
(6)试验结束后,将三颈烧瓶中混合物分离开的实验操作是蒸馏
(已知SCl2的沸点为50℃)若反应中消耗的Cl2的体积为896ml(已转化为标准状况,SO2足量),最后得到纯净的SOCl2 4.76g,则SOCl2的产率为50%(保留三位有效数字).
(7)分离产物后,向获得的SOCl2中加入足量NaOH溶液,振荡、静止得到无色溶液w,检验溶液w中存在的Cl-的方法是取少量无色溶液放入试管中,加入Ba(NO3)2溶液至不再生沉淀为止,静置,取出上层清液,加入AgNO3溶液,有白色沉淀生成,可知无色溶液中含有Cl-.

如图1已知:①过氧化氢能将Cr(OH)3氧化为CrO42-.
②金属离子氢氧化物开始沉淀时和沉淀完全时的pH及Ksp如下:
| 氢氧化物 | Ksp | 开始沉淀时的pH | 沉淀完全的pH |
| Fe(OH)3 | 2.5×10-38 | 2.3 | 3.5 |
| Fe(OH)2 | 1.0×10-15 | 7.5 | 9.5 |
| Al(OH)3 | 2.0×10-32 | 4.0 | 5.4 |
| Cr(OH)3 | 5.4×10-31 | 4.6 | 5.9 |
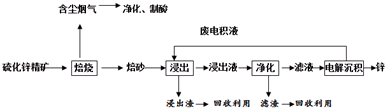
(2)操作I的名称是过滤,固体a的主要成分是SiO2.
(3)写出浸取时生成Al3+的离子方程式:Al2O3+6H+=2Al3++3H2O.
(4)调节pH的范围是C.
A.3.5〜4.0 B.4.6〜5.4 C.5.9〜7.5
(5)写出H2O2氧化Cr(OH)3生成Na2CrO4的化学方程式2Cr(OH)3+3H2O2+2Na2CO3=2Na2CrO4+6H2O+2CO2↑.
(6)当溶液中Al3+开始沉淀时,c(Fe3+)=2.5×10-8mol/L.
(7)取粗产品用硝酸酸化,再加水配制成1000mL溶液,取20mL于试管中,通入标准状况下SO2的体积与铬离子(Cr3+)物质的量的关系如图2该工艺流程中铬铁矿中铬的利用率是80%.[已知氧化性:CrO42->NO3 (H+)].
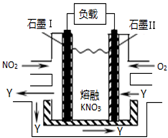 (1)NO2、O2和熔融NaNO3可制作燃料电池,其原理如图.该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为NO2+NO3--e-═N2O5.若生成1molY,则需要消耗标准状况下氧气的体积为5.6L.
(1)NO2、O2和熔融NaNO3可制作燃料电池,其原理如图.该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为NO2+NO3--e-═N2O5.若生成1molY,则需要消耗标准状况下氧气的体积为5.6L.