题目内容
7.铬酸钙(CaCrO4)俗称钙铬黄,溶于水.广泛用作氧化剂、腐蚀抑制剂、颜料等.铬铁矿中铬的含量为19.5%,其主要成分为 FeO•Cr2O3,还含Fe2O3、SiO2、Al2O3等杂质,以该铬铁矿为原料制备钙铬黄的工艺流程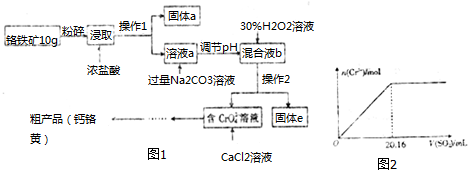
如图1已知:①过氧化氢能将Cr(OH)3氧化为CrO42-.
②金属离子氢氧化物开始沉淀时和沉淀完全时的pH及Ksp如下:
| 氢氧化物 | Ksp | 开始沉淀时的pH | 沉淀完全的pH |
| Fe(OH)3 | 2.5×10-38 | 2.3 | 3.5 |
| Fe(OH)2 | 1.0×10-15 | 7.5 | 9.5 |
| Al(OH)3 | 2.0×10-32 | 4.0 | 5.4 |
| Cr(OH)3 | 5.4×10-31 | 4.6 | 5.9 |
(2)操作I的名称是过滤,固体a的主要成分是SiO2.
(3)写出浸取时生成Al3+的离子方程式:Al2O3+6H+=2Al3++3H2O.
(4)调节pH的范围是C.
A.3.5〜4.0 B.4.6〜5.4 C.5.9〜7.5
(5)写出H2O2氧化Cr(OH)3生成Na2CrO4的化学方程式2Cr(OH)3+3H2O2+2Na2CO3=2Na2CrO4+6H2O+2CO2↑.
(6)当溶液中Al3+开始沉淀时,c(Fe3+)=2.5×10-8mol/L.
(7)取粗产品用硝酸酸化,再加水配制成1000mL溶液,取20mL于试管中,通入标准状况下SO2的体积与铬离子(Cr3+)物质的量的关系如图2该工艺流程中铬铁矿中铬的利用率是80%.[已知氧化性:CrO42->NO3 (H+)].
分析 铬铁矿中铬的含量为19.5%,其主要成分为 FeO•Cr2O3,还含Fe2O3、SiO2、Al2O3等杂质,以该铬铁矿为原料制备钙铬黄,取10g铬铁矿粉碎后加入浓盐酸浸取,其中FeO•Cr2O3,还含Fe2O3、Al2O3等溶解,得到溶液a为FeCl2、FeCl3、CrCl3、AlCl3溶液,SiO2不溶,操作Ⅰ为过滤操作得到固体a为SiO2,溶液a中加入过量的Na2CO3溶液,调节溶液的pH值,然后加入30%的双氧水,双氧水能氧化亚铁离子生成铁离子、能将Cr(OH)3氧化为CrO42-,根据流程图知,操作2后得到固体e、CrO42-,CrO42-最终得到钙铬黄,所以固体e中含有Al(OH)3、Fe(OH)3,调节溶液pH值时不能得到氢氧化亚铁沉淀即可;
(1)反应物接触面积越大,反应速率越快;
(2)分离溶液和难溶性固体采用过滤方法;二氧化硅不溶于浓盐酸;
(3)氧化铝和盐酸反应生成氯化铝和水;
(4)调节pH的目的是将铁离子、铬离子、铝离子都转化为沉淀;
(5)H2O2氧化Cr(OH)3生成Na2CrO4,同时生成水,因为有碳酸钠反应,所以还生成二氧化碳;
(6)当溶液中Al3+开始沉淀时,溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-4}}$mol/L=10-10 mol/L,c(Fe3+)=$\frac{{K}_{sp}}{{c}^{3}(O{H}^{-})}$;
(7)CaCrO4被二氧化硫还原生成 Cr3+,消耗二氧化硫体积为20.16mL,n(SO2)=$\frac{20.16×1{0}^{-3}L}{22.4mol/L}$=9×10-4 mol,根据转移电子守恒得n(CaCrO4)=$\frac{9×1{0}^{-4}mol×2}{3}$=6×10-4 mol,粗产品中Cr元素质量=6×10-4 mol×52g/mol×50=1.56g,铬矿石的质量是10g,则Cr元素质量分数=$\frac{1.56g}{10g}$×100%=15.6%.
解答 解:铬铁矿中铬的含量为19.5%,其主要成分为 FeO•Cr2O3,还含Fe2O3、SiO2、Al2O3等杂质,以该铬铁矿为原料制备钙铬黄,取10g铬铁矿粉碎后加入浓盐酸浸取,其中FeO•Cr2O3,还含Fe2O3、Al2O3等溶解,得到溶液a为FeCl2、FeCl3、CrCl3、AlCl3溶液,SiO2不溶,操作Ⅰ为过滤操作得到固体a为SiO2,溶液a中加入过量的Na2CO3溶液,调节溶液的pH值,然后加入30%的双氧水,双氧水能氧化亚铁离子生成铁离子、能将Cr(OH)3氧化为CrO42-,根据流程图知,操作2后得到固体e、CrO42-,CrO42-最终得到钙铬黄,所以固体e中含有Al(OH)3、Fe(OH)3,调节溶液pH值时不能得到氢氧化亚铁沉淀即可;
(1)反应物接触面积越大,反应速率越快,粉碎的目的是增大接触面积,提高浸取率,
故答案为:增大接触面积、提高浸取率;
(2)分离溶液和难溶性固体采用过滤方法,所以操作I为过滤;二氧化硅不溶于浓盐酸,所以a为SiO2,
故答案为:过滤;SiO2;
(3)氧化铝和盐酸反应生成氯化铝和水,离子反应方程式为Al2O3+6H+=2Al3++3H2O,故答案为:Al2O3+6H+=2Al3++3H2O;
(4)调节pH的目的是将铁离子、铬离子、铝离子都转化为沉淀但不能生成氢氧化亚铁沉淀,所以调节溶液的pH值为5.9〜7.5,
故选C;
(5)H2O2氧化Cr(OH)3生成Na2CrO4,同时生成水,因为有碳酸钠反应,所以还生成二氧化碳,反应方程式为2Cr(OH)3+3H2O2+2Na2CO3=2Na2CrO4+6H2O+2CO2↑,故答案为:2Cr(OH)3+3H2O2+2Na2CO3=2Na2CrO4+6H2O+2CO2↑;
(6)当溶液中Al3+开始沉淀时,溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-4}}$mol/L=10-10 mol/L,c(Fe3+)=$\frac{{K}_{sp}}{{c}^{3}(O{H}^{-})}$=$\frac{2.5×1{0}^{-38}}{(1{0}^{-10})^{3}}$mol/L=2.5×10-8 mol/L,
故答案为:2.5×10-8mol/L;
(7)CaCrO4被二氧化硫还原生成 Cr3+,消耗二氧化硫体积为20.16mL,n(SO2)=$\frac{20.16×1{0}^{-3}L}{22.4mol/L}$=9×10-4 mol,根据转移电子守恒得n(CaCrO4)=$\frac{9×1{0}^{-4}mol×2}{3}$=6×10-4 mol,粗产品中Cr元素质量=6×10-4 mol×52g/mol×50=1.56g,铬矿石的质量是10g,则Cr元素质量分数=$\frac{1.56g}{10g}$×100%=15.6%,所以该工艺流程中铬铁矿中铬的利用率=$\frac{15.6%}{19.5%}×100%$=80%,
故答案为:80%.
点评 本题考查物质分离和提纯,为高频考点,侧重考查学生分析判断及知识综合运用能力,涉及方程式计算、氧化还原反应、化学反应速率影响因素、溶度积常数计算等知识点,明确物质性质、化学反应原理等知识点是解本题关键,注意(7)中易漏掉计算1000mL溶液中Cr元素质量,为易错点.

| A. | 用O3替代Cl2作饮用水消毒剂更符合绿色化学的要求 | |
| B. | “光化学烟雾”、“臭氧空洞”的形成都与氮氧化合物有关 | |
| C. | 尽量使用含12C的产品,减少使用含13C或14C的产品符合“促进低碳经济”宗旨 | |
| D. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
| A. | 112 mL | B. | 224 mL | C. | 336 mL | D. | 448 mL |
 将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是( )
将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是( )| A | B | C | D | |
| X | CO2 | HCl | NaOH | AlCl3 |
| Y | Ca(OH)2 | Na[Al(OH)4] | AlCl3 | NaOH |
| A. | A | B. | B | C. | C | D. | D |
①放出的气体中除SO2外还有H2;
②反应结束时转移的电子的总物质的量为4mol;
③只放出SO2气体,其物质的量为1mol;
④反应结束后加入KNO3固体Zn粉继续溶解.
| A. | 只有① | B. | 只有② | C. | 只有③ | D. | 只有②③④ |
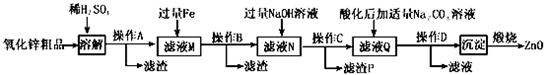
已知:Zn(OH)2可溶于NaOH溶液.一些阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Fe(OH)2 |
| pH | 3.2 | 6.7 | 8.0 | 9.7 |
(2)“溶解”前将氧化锌粗品粉碎成细颗粒,目的是增大固液接触面积,加快溶解时的反应速率.
(3)加入过量铁可回收的金属是Cu.
(4)常温下若向滤液N中加入适量的H2O2溶液,再加一定量某试剂调节溶液pH=5,则Fe3+浓度为4.0×10-7mol/L(已知Ksp[Fe(OH)3]=4.0×10-34)
(5)用K3[Fe(CN)6](铁氰化钾)验证N中Fe2+的现象是有蓝色沉淀生成.
(6)“沉淀”的成分为ZnCO3•2Zn(OH)2•H2O,“煅烧”在450~500℃下进行,煅烧获得ZnO的反应的化学方程式为ZnCO3•2Zn(OH)2•H2O$\frac{\underline{\;450℃-500℃\;}}{\;}$3ZnO+CO2↑+3H2O↑.
(7)取20.00mL.滤渡N,用0.02mol/L的KMnO4溶液进行滴定,消耗KMnO4溶液18.00mL,则滤液N中Fe2+的浓度为0.09mol/L.