题目内容
10.二氧化氯(ClO2)是高效安全的饮用水消毒剂,得到越来越广泛的应用.回答下列问题:(1)实验室合成ClO2常用盐酸或双氧水还原氯酸钠(NaClO3).
①盐酸和NaClO3反应时有ClO2和Cl2生成,反应的离子方程式为2ClO3-+4H++2Cl-=2ClO2↑+Cl2↑+2H2O,当反应中转移0.2mol 电子时,参加反应的还原剂的物质的量为0.2mol.
②使用双氧水作还原剂的优点是使用双氧水作还原剂时氧化产物为氧气,对环境无污染.
(2)ClO2可用于合成亚氯酸钠(NaClO2).将ClO2通入NaOH溶液中,并加入适量双氧水,在稳定装置中充分反应可制得NaClO2成品. 已知:当pH≤2.0时,NaClO2能被I-完全还原成Cl-;二氧化氯(ClO2)是高效安全的饮用水消毒剂,得到越来越广泛的应用.回答下列问题:
溶液中Na2S2O3能与I2反应生成NaI和Na2S4O6.欲测定成品中NaClO2的含量,现进行如下操作:
| 步骤Ⅰ | 称取样品Wg配成溶液置于锥形瓶中,并调节PH≤2.0 |
| 步骤Ⅱ | 向锥形瓶中加入足量KI晶体,充分搅拌,并加入少量指示剂 |
| 步骤Ⅲ | 用c mol/L的Na2S2O3溶液滴定 |
②若上述滴定操作中平均消耗VmL Na2S2O3标准溶液,则成品中NaClO2的质量分数为$\frac{9.05×10{\;}^{-2}VC}{4W}$×100%(用含w、c、V的代数式表示).
(3)ClO2和Cl2均能将电镀废水中的CN-氧化为无毒的物质,自身被还原为Cl-.处理含相同量CN-的电镀废水,所需Cl2的物质的量是ClO2的2.5倍.
分析 (1)①盐酸和NaClO3反应时有ClO2和Cl2生成,反应中HCl为还原剂,被氧化生成氯气,化合价由-1价升高到0价,NaClO3被还原成ClO2,氯从+5价变为+4价,据此书写离子方程式和计算还原剂的物质的量;
②双氧水作还原剂时氧化产物为氧气,对环境无污染;
(2)①步骤Ⅱ中发生反应是酸性溶液中ClO2-能被I-完全还原成Cl-,碘离子被氧化为碘单质,溶液中Na2S2O3能与I2反应:2Na2S2O3+I2=2NaI+Na2S4O6,可以用淀粉溶液作指示剂,判断反应终点;
②依据ClO2-+4H++4I-=2I2+Cl-+2H2O,2Na2S2O3+I2=2NaI+Na2S4O6,反应的定量关系计算得到;
(3)每摩尔Cl2得到2mol电子,而每摩尔ClO2得到5mol电子,故为2.5倍.
解答 解:(1)①盐酸和NaClO3反应时有ClO2和Cl2生成,反应的离子方程式为 2ClO3-+4H++2Cl-=2ClO2↑+Cl2↑+2H2O,反应中HCl为还原剂,被氧化生成氯气,化合价由-1价升高到0价,当转移0.2mol电子时,参加反应的还原剂的物质的量为为0.2mol,
故答案为:2ClO3-+4H++2Cl-=2ClO2↑+Cl2↑+2H2O;0.2mol.
②双氧水作还原剂时氧化产物为氧气,对环境无污染,
故答案为:使用双氧水作还原剂时氧化产物为氧气,对环境无污染;
(2)①步骤Ⅱ中发生反应是酸性溶液中ClO2-能被I-完全还原成Cl-,碘离子被氧化为碘单质,离子方程式为:ClO2-+4H++4I-=2I2+Cl-+2H2O,溶液中Na2S2O3能与I2反应:2Na2S2O3+I2=2NaI+Na2S4O6,可以用淀粉溶液作指示剂,
故答案为:ClO2-+4H++4I-=2I2+Cl-+2H2O,淀粉溶液;
②依据ClO2-+4H++4I-=2I2+Cl-+2H2O,2Na2S2O3+I2=2NaI+Na2S4O6,反应的定量关系计算得到,设NaClO2,
ClO2-~2I2~4Na2S2O3+
1 4
x cV×10-3mol
x=$\frac{cV×10{\;}^{-3}}{4}$,
样品中NaClO2的质量分数=$\frac{\frac{cV×10{\;}^{-3}}{4}mol×90.5g/mol}{Wg}$×100%=$\frac{9.05×10{\;}^{-2}VC}{4W}$×100%,
故答案为:$\frac{9.05×10{\;}^{-2}VC}{4W}$×100%.
(3)每摩尔Cl2得到2mol电子,而每摩尔ClO2得到5mol电子,则所需Cl2的物质的量是ClO2的:$\frac{5mol}{2mol}$=2.5倍,
故答案为:2.5.
点评 本题考查亚氯酸钠制备实验的基本操作、亚氯酸钠的性质及中和滴定等知识,理解原理是解题的关键,同时考查学生分析问题、解决问题的能力,难度较大.

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案| A. | 用O3替代Cl2作饮用水消毒剂更符合绿色化学的要求 | |
| B. | “光化学烟雾”、“臭氧空洞”的形成都与氮氧化合物有关 | |
| C. | 尽量使用含12C的产品,减少使用含13C或14C的产品符合“促进低碳经济”宗旨 | |
| D. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
| A. | 用pH计测定0.1mol/L氨水的pH | |
| B. | 用pH试纸测定0.1mol/LNH4Cl溶液的pH | |
| C. | 将氨水连接在一个带灯泡的通电电路中,观察灯泡亮度 | |
| D. | 等浓度、等体积的氨水和NaOH分别与等浓度的盐酸反应,比较消耗盐酸体积的多少 |
| A. | H2SO4的摩尔质量是98 | |
| B. | 通电时,溶液中的溶质分子分别向两极移动,胶体中的分散质粒子向某一极移动 | |
| C. | 丁达尔效应可用于区别溶液和胶体,云、雾均能产生丁达尔效应 | |
| D. | 将98gH2SO4溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2mol/L |
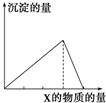 将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是( )
将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是( )| A | B | C | D | |
| X | CO2 | HCl | NaOH | AlCl3 |
| Y | Ca(OH)2 | Na[Al(OH)4] | AlCl3 | NaOH |
| A. | A | B. | B | C. | C | D. | D |
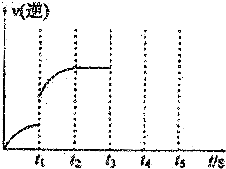 Ⅰ.体积为5L的恒温、恒容密闭容器甲起始投入2molN2、3molH2经过l0s达平衡,测得平衡时NH3的物质的量为0.8mol.
Ⅰ.体积为5L的恒温、恒容密闭容器甲起始投入2molN2、3molH2经过l0s达平衡,测得平衡时NH3的物质的量为0.8mol.