题目内容
【题目】在一个容积为2L的密闭容器中,加入0.8mol A2气体和0.6mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)═2AB(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示.下列说法正确的是( ) 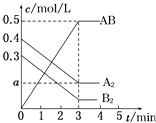
A.图中a点的值为0.05
B.该反应的平衡常数K=0.03
C.平衡时A2的转化率为62.5%
D.温度升高,平衡常数K值增大
【答案】C
【解析】解:A、当AB的浓度改变0.5 molL﹣1 , 由方程式A2(g)+B2(g)2AB(g)知,A2的浓度改变为0.25molL﹣1 , 所以a=(0.4﹣0.25)molL﹣1=0.15molL﹣1 , 即图中a点的值为0.15,故A错误;B、当AB的浓度改变0.5 molL﹣1 , 由方程式知,B2的浓度改变为0.25molL﹣1 , 所以平衡时B2的浓度为=(0.3﹣0.25)molL﹣1=0.05molL﹣1 , K= ![]() =
= ![]() =
= ![]() ,故B错误;
,故B错误;
C.当AB的浓度改变0.5 molL﹣1 , 由方程式知,A2的浓度改变为0.25molL﹣1 , 已知A2的初始量为0.4molL﹣1 , 所以平衡时A2的转化率为: ![]() ×100%=62.5%,故C正确;
×100%=62.5%,故C正确;
D.反应A2(g)+B2(g)2AB(g)的△H<0,为放热反应,所以温度升高,平衡逆移,平衡常数K值减小,故D错误;
故选C.
A.根据AB的浓度变化结合反应方程式计算A2的浓度变化,从而得出a值;
B.根据化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比进行计算;
C.根据转化的A2的量和A2的初始量求算;
D.根据放出热量即△H<0,所以温度升高,平衡逆移,平衡常数K值减小.

【题目】粉煤灰(主要含有SiO2、Fe2O3、Al2O3等)是燃煤发电过程中产生的废渣,粉煤灰的综合利用具有很大的价值.
Ⅰ.研究人员通过实验对粉煤灰中铝和铁元素的分离工艺进行了研究.
(1)以硫酸溶液分解粉煤灰,使其中的铝、铁元素溶出,过滤实现初步分离.
①写出硫酸溶液与Fe2O3反应的离子方程式 .
②初步分离得到的滤渣主要成分是 .
(2)向(1)分离所得的滤液中加入还原剂使Fe3+转化为Fe2+ , 结合表分析其原因 .
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
沉淀区间(pH) | 7.06~8.95 | 1.94~3.20 | 3.69~4.8 |
(3)使用碱性较弱的氨水为pH调节剂,进行分离实验.
①氨水使滤液中铝离子沉淀的离子方程式为 .
②反应终点的pH对铝和铁分离效果的影响如图1.根据实验结果,为达到好的分离效果,反应过程中控制pH的范围是 , 选择该范围的理由是 . 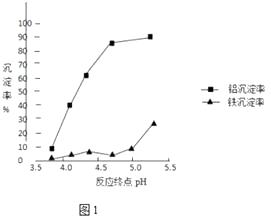
(4)Ⅱ.NH4HSO4和H2SO4按物质的量比1:1混合配制成浸取液,220℃时,可将高铝粉煤灰中Al2O3转化为硫酸铝铵[NH4Al(SO4)2],然后分离、煅烧获得纯Al2O3 .
已知硫酸铝铵:①溶解度:0℃时,S=5.2g;100℃时,S=421.9g.
②280℃时分解.
依据资料可知,将硫酸铝铵与其他溶质分离的方法是 .
(5)煅烧NH4Al(SO4)2同时得到混合气体(NH3、N2、SO2、SO3、H2O).若16mol混合气体按图2装置被完全吸收制得浸取液,请将图2中试剂及其物质的量补充完整.


