题目内容
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 120克NaHSO4固体含有离子数目为3NA
B. 总质量为1g的O2与N2混合气体含有的电子数为0.5NA
C. Na2O2与CO2反应时,每产生1 mol O2转移电子数为NA
D. 向含有FeI2的溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,共转移电子数目为NA
【答案】B
【解析】A. 120克NaHSO4的物质的量是1mol,固体含有离子数目为2NA,A错误;B. 设氧气的质量是xg、氮气是1g-xg,则总质量为1g的O2与N2混合气体含有的电子数为![]() ,B正确;C. Na2O2与CO2反应时,每产生1 mol O2转移电子数为2NA,C错误;D. 碘离子的还原性强于亚铁离子,向含有FeI2的溶液中通入适量Cl2,当有1 mol Fe2+被氧化时2mol碘离子已经全部被氧化,共转移电子的物质的量是3mol,D错误,答案选B。
,B正确;C. Na2O2与CO2反应时,每产生1 mol O2转移电子数为2NA,C错误;D. 碘离子的还原性强于亚铁离子,向含有FeI2的溶液中通入适量Cl2,当有1 mol Fe2+被氧化时2mol碘离子已经全部被氧化,共转移电子的物质的量是3mol,D错误,答案选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
写出氨气催化氧化生成一氧化氮气体和水蒸气的热化学反应方程式。
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g) ![]() 2NH3(g)反应的影响,实验结果如图所示:(图中T表示温度,n表示物质的量)
2NH3(g)反应的影响,实验结果如图所示:(图中T表示温度,n表示物质的量)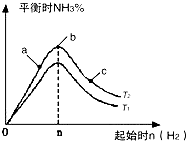
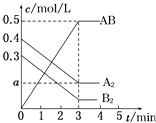
①图象中T2和T1的关系是:T2T1(填“高于”、“低于”、“等于”、“无法确定”).
②若比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是(填字母).
(3)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g) ![]() 4NO2(g) + O2(g).△H﹥0,下表为反应在T1温度下的部分实验数据:
4NO2(g) + O2(g).△H﹥0,下表为反应在T1温度下的部分实验数据:
| 0 | 500 | 1000 |
| 5.00 | 3.52 | 2.48 |
①500s内NO2的平均生成速率为。
②该反应的化学平衡常数表达式为。