��Ŀ����
����Ŀ��ij�¶ȣ�T�棩�µ���Һ�У�c��H+��=10��x molL��1 �� c��OH����=10��y molL��1 �� x��y�Ĺ�ϵ��ͼ��ʾ����ش��������⣺ 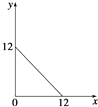
��1�����¶��£�ˮ�����ӻ�KwΪ �� ����¶�T25�����������������=������
��2���ڴ��¶��£���Ba��OH��2��Һ����μ���pH=a�����ᣬ��û����Һ�IJ���pH�����ʾ��
ʵ����� | Ba��OH��2��Һ�����/mL | ��������/mL | ��Һ��pH |
�� | 22.00 | 0.00 | 8 |
�� | 22.00 | 18.00 | 7 |
�� | 22.00 | 22.00 | 6 |
������Һ���ǰ�������仯���Բ��ƣ���a= �� ʵ�������ˮ���������c��OH����=molL��1��
��3���ڴ��¶��£���0.1molL��1��NaHSO4��Һ��0.1molL��1��Ba��OH��2��Һ���±��мס��ҡ���������ͬ��ʽ��ϣ�
�� | �� | �� | �� | |
0.1molL��1 Ba��OH��2��Һ���/mL | 10 | 10 | 10 | 10 |
0.1molL��1 NaHSO4��Һ���/mL | 5 | 10 | 15 | 20 |
�ٰ�����ʽ��Ϻ�������Һ������ᡱ��������С����ԣ�
��д�����ҷ�ʽ��Ϻ�Ӧ�����ӷ���ʽ�� ��
�۰���ʽ��Ϻ�������Һ��pHΪ ��
���𰸡�
��1��1��10��12����
��2��4��10��7
��3����Ba2++OH��+H++SO42���TBaSO4��+H2O��11
���������⣺��1��Kw=c��H+��c��OH����=10��x10��y=10����x+y�� �� ����ͼʾ��֪��x=12ʱ��c��OH����=1mol/L����y=12ʱ��c��H+��=1mol/L����Kw=1��10��12�������¶�Խ��ˮ�ĵ���̶�Խ��KwҲ��֮Խ��֪��ʱ��T��25�� ���Դ��ǣ�1��10��12��������2���������£�pH=6ʱ����Һ�����ԣ����ݱ���ʵ��ٵ����ݿɵ�c��OH����=10��4mol/L�����ݱ���ʵ��۵�������22.00��10��3L��10��4mol/L=22.00��10��3L��10��amol/L���ɵ�a=4����pH=4��ʵ����У�������ҺpH=7��Ba��OH��2��������Һ�ʼ��ԣ���H2O���������c��OH����������ˮ���������c��H+��������ˮ���������c��OH����=10��7mol/L��
���Դ��ǣ�4��10��7����3���ٰ�����ʽ���ʱ��Ba��OH��2�ṩ��OH����NaHSO4�ṩ��H+��ȣ���Ϻ���Һ�����ԣ�
���Դ��ǣ��У�
�ڰ��ҷ�ʽ���ʱ����Ӧǰ��n��Ba2+��=10��3mol��n��OH����=2��10��3mol��n��H+��=n��SO42����=10��3mol��ʵ�ʷ�Ӧ��Ba2+��OH����H+��SO42�� ��Ϊ10��3mol���ʷ�Ӧ�����ӷ���ʽΪBa2++OH��+H++SO42���TBaSO4��+H2O��
���Դ��ǣ�Ba2++OH��+H++SO42���TBaSO4��+H2O��
�۰���ʽ���ʱ��OH����������Ӧ����Һ��c��OH����= ![]() =0.1mol/L��c��H+��=10��11mol/L����Һ��pH=11��
=0.1mol/L��c��H+��=10��11mol/L����Һ��pH=11��
���Դ��ǣ�11��