题目内容
【题目】含有下列离子的水溶液.长期露置在空气中会变质,但不是被氧化的是( )
A. Fe2+ B. OH- C. SO32- D. S2-
【答案】B
【解析】A.Fe2+易被空气中的氧气氧化为Fe3+,故A正确;B.OH-易吸收空气中的CO2而变质,为非氧化还原反应,故B错误;C.SO32-易被空气中的氧气氧化为SO42-,故C正确; D.S2-易被空气中的氧气氧化为S,故D正确;答案为B。

【题目】已知合成氨反应的浓度数据如下,当用氨气浓度的增加来表示该化学反应速率时,其速率为( )
N2+3H22NH3 | |||
起始浓度mol/L | 1.0 | 3.0 | 0 |
2秒末浓度mol/L | 0.6 | 1.8 | a |
A.0.2mol/(Ls)
B.0.4mol/(Ls)
C.0.6mol/(Ls)
D.0.8mol/(Ls)
【题目】节能减排是当下环境保护的重点。
(1)将CO和气态水通入一个体积固定的密闭容器中,在一定条件下发生如下可逆反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),ΔH<0,800℃下,在2 L恒容密闭容器中,起始时按照下表数据进行投料,达到平衡状态,K=1.0。
CO2(g)+H2(g),ΔH<0,800℃下,在2 L恒容密闭容器中,起始时按照下表数据进行投料,达到平衡状态,K=1.0。
H2O | CO | CO2 | H2 | |
n/mol | 0.30 | 0.20 | 0 | 0 |
①从起始经过5 min达到化学平衡时,用生成物CO2表示该反应的化学反应速率v(CO2)=___________________;平衡时,容器中CO的转化率为_____________
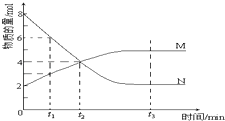
②下图表示上述反应在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况。则t2时刻发生改变的条件可能是_______________(写出一条即可)。
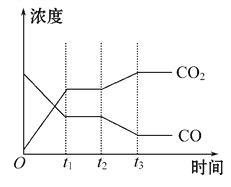
(2)汽车尾气中的一氧化碳是大气污染物,可通过反应:CO(g)+ ![]() O2(g)
O2(g)![]() CO2(g)降低其浓度。某温度下,在两个容器中进行上述反应,容器中各物质的浓度及正、逆反应速率关系如下表所示,并请在表中的空格处填写“>”“<”或“=”。
CO2(g)降低其浓度。某温度下,在两个容器中进行上述反应,容器中各物质的浓度及正、逆反应速率关系如下表所示,并请在表中的空格处填写“>”“<”或“=”。
容器 编号 | c(CO)/ mol·L-1 | c(O2)/ mol·L-1 | c(CO2)/ mol·L-1 | v(正)和v(逆) 比较 |
Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v(正)=v(逆) |
Ⅱ | 5.0×10-4 | 4.0×10-4 | 6.0×10-2 | v(正)______v(逆) |
该温度下,2CO(g)+O2(g)![]() 2CO2(g)的平衡常数为____________
2CO2(g)的平衡常数为____________
【题目】某温度(T℃)下的溶液中,c(H+)=10﹣x molL﹣1 , c(OH﹣)=10﹣y molL﹣1 , x与y的关系如图所示,请回答下列问题: 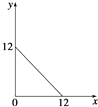
(1)此温度下,水的离子积Kw为 , 则该温度T25(填“>”、“<”或“=”).
(2)在此温度下,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示.
实验序号 | Ba(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
① | 22.00 | 0.00 | 8 |
② | 22.00 | 18.00 | 7 |
③ | 22.00 | 22.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则a= , 实验②中由水电离产生的c(OH﹣)=molL﹣1.
(3)在此温度下,将0.1molL﹣1的NaHSO4溶液与0.1molL﹣1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
甲 | 乙 | 丙 | 丁 | |
0.1molL﹣1 Ba(OH)2溶液体积/mL | 10 | 10 | 10 | 10 |
0.1molL﹣1 NaHSO4溶液体积/mL | 5 | 10 | 15 | 20 |
①按丁方式混合后,所得溶液显(填“酸”、“碱”或“中”)性.
②写出按乙方式混合后,反应的离子方程式: .
③按甲方式混合后,所得溶液的pH为 .