题目内容
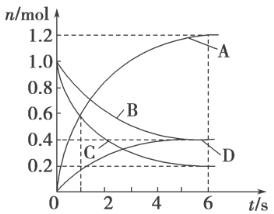
【题目】某温度下,在密闭容器中SO2、O2、SO3三种气态物质建立化学平衡后,改变条件对反应2SO2(g)+O2(g)2SO3(g),△H<0的正、逆反应速率的影响如图所示: 
(1)加催化剂对反应速率影响的图像是(填序号,下同),平衡移动.
(2)升高温度对反应速率影响的图像是 , 平衡向方向移动.
(3)增大反应容器体积对反应速率影响的图像是 , 平衡向方向移动.
(4)增大O2的浓度对反应速率影响的图像是 , 平衡向方向移动.
【答案】
(1)C;不
(2)A;逆反应
(3)D;逆反应
(4)B;正反应
【解析】解:(1)催化剂只影响反应速率,不影响化学平衡,所以加入催化剂后正逆反应速率同时增大且相等,化学平衡不发生移动,所以C正确; 故答案为:C;不;(2)升高温度后,正反应速率和逆反应速率都增大,由于该反应为放热反应,平衡向着逆反应方向移动,说明逆反应速率大于正反应速率,所以A正确,
故答案为:A;逆反应;(3)该反应为体积缩小的反应,增大反应容器体积,反应体系压强减小,正逆反应速率都会减小,平衡向着体积增大的逆反应方向移动,说明逆反应速率减小幅度减小,即逆反应速率大于正反应速率,满足该变化的图像为D,
故答案为:D;逆反应;(4)增大O2的浓度的瞬间,逆反应速率不变,正反应速率增大,平衡向着正反应方向移动,满足该变化的图像为B,
故答案为:B;正反应.
(1)加入催化剂,正逆反应速率同时增大,且增大幅度相同,催化剂不影响化学平衡;(2)该反应为放热反应,升高温度,正逆反应速率都增大,由于平衡向着逆向移动,逆反应速率增大幅度大于正反应速率;(3)增大反应容器体积,减小了压强,正逆反应速率都减小,平衡向着体积增大的逆反应方向移动;(4)增大反应物浓度的瞬间,正反应速率增大,逆反应速率不变,之后正反应速率逐渐减小,逆反应速率逐渐增大,直至达到新的平衡.

【题目】某温度(T℃)下的溶液中,c(H+)=10﹣x molL﹣1 , c(OH﹣)=10﹣y molL﹣1 , x与y的关系如图所示,请回答下列问题: 
(1)此温度下,水的离子积Kw为 , 则该温度T25(填“>”、“<”或“=”).
(2)在此温度下,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示.
实验序号 | Ba(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
① | 22.00 | 0.00 | 8 |
② | 22.00 | 18.00 | 7 |
③ | 22.00 | 22.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则a= , 实验②中由水电离产生的c(OH﹣)=molL﹣1.
(3)在此温度下,将0.1molL﹣1的NaHSO4溶液与0.1molL﹣1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
甲 | 乙 | 丙 | 丁 | |
0.1molL﹣1 Ba(OH)2溶液体积/mL | 10 | 10 | 10 | 10 |
0.1molL﹣1 NaHSO4溶液体积/mL | 5 | 10 | 15 | 20 |
①按丁方式混合后,所得溶液显(填“酸”、“碱”或“中”)性.
②写出按乙方式混合后,反应的离子方程式: .
③按甲方式混合后,所得溶液的pH为 .