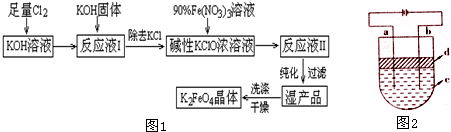
题目内容
13.实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4的主要流程如下:
(1)为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入B(填“A”或“B“),再滴加另一反应物.
(2)判断流程中沉淀是否洗净所用的试剂是AgNO3溶液(或硝酸酸性的AgNO3溶液).高温焙烧时,用于盛放固体的仪器名称是坩埚.
(3)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用如图所示装置制备.

装置B中盛放的试剂为饱和食盐水.G中试剂的作用是吸收反应的尾气氯气,防止污染空气.
用一件仪器装填适当试剂后可起到F和G的双重作用,所装填的试剂为:碱石灰.
(4)该装置存在一个可造成事故的缺点是:D、E之间的导管可能被堵塞而导致发生爆炸事故.
分析 MgCl2、AlCl3的混合溶液与过量氨水反应生成氢氧化镁和氢氧化铝沉淀,再经过过滤、洗涤、干燥得氢氧化镁和氢氧化铝沉淀,再在高温焙烧得到MgAl2O4固体,(1)先加入氨水,再加入盐的混合溶液,会使两种沉淀同时生成;
(2)根据题意可知,沉淀中应该附着氯离子和铵根离子,若判断是否洗净,可以取少量最后一次洗涤液,加入硝酸酸化的硝酸银溶液进行判断,若生成白色沉淀,则说明没有洗涤干净;若没有沉淀生成,则说明已经洗涤干净;
(3)根据所给的装置图可知,装置A是实验室利用浓盐酸与二氧化锰反应制取氯气,制得的氯气中有水和氯化氢杂质,氯化铝易水解,所以B中装饱和食盐水是为了除去混有的HCl气体,C中装浓硫酸,干燥氯气,因为氯化铝易发生水解,故应该防止空气中的水蒸气进入E装置,而G是用氢氧化钠溶液吸收反应的尾气氯气,所以可以加入碱石灰来代替F和G的作用;
(4)氯气与铝反应生成无水AlCl3(183℃升华),所以氯化铝气体进入E装置前有可能在导管里冷凝成固体,而堵塞导管.
解答 解:MgCl2、AlCl3的混合溶液与过量氨水反应生成氢氧化镁和氢氧化铝沉淀,再经过过滤、洗涤、干燥得氢氧化镁和氢氧化铝沉淀,再在高温焙烧得到MgAl2O4固体;
(1)如先加入MgCl2、AlCl3的混合溶液,再加氨水,氨水少量,应先生成氢氧化镁沉淀,反之,先加氨水,因氨水足量,则同时生成沉淀,
故答案为:B;
(2)沉淀中应该附着氯离子和铵根离子,若判断是否洗净,可以取少量最后一次洗涤液,加入AgNO3溶液(或硝酸酸性的AgNO3溶液)溶液进行判断,若生成白色沉淀,则说明没有洗涤干净;若没有沉淀生成,则说明已经洗涤干净,高温焙烧固体应在坩埚中进行,
故答案为:AgNO3溶液(或硝酸酸性的AgNO3溶液);坩埚;
(3)根据所给的装置图可知,装置A是实验室利用浓盐酸与二氧化锰反应制取氯气,制得的氯气中有水和氯化氢杂质,氯化铝易水解,所以B中装饱和食盐水是为了除去混有的HCl气体,C中装浓硫酸,干燥氯气,因为氯化铝易发生水解,故应该防止空气中的水蒸气进入E装置,而G是用氢氧化钠溶液吸收反应的尾气氯气,防止污染空气,所以可以加入碱石灰来代替F和G的作用,
故答案为:饱和食盐水;吸收反应的尾气氯气,防止污染空气;碱石灰;
(4)氯气与铝反应生成无水AlCl3(183℃升华),所以氯化铝气体进入E装置前有可能在导管里冷凝成固体,而堵塞导管,
故答案为:D、E之间的导管可能被堵塞而导致发生爆炸事故.
点评 本题考查物质的制备实验设计,涉及实验操作目的、原理、步骤等有关问题,主要考查了实验方案设计中的实验操作,综合考查了学生的实验探究能力,注意(3)F用球形干燥管代替F中可以用碱石灰(或NaOH与CaO混合物),既能吸收尾气氯气,又能防止空气中水蒸气进入E装置,为易错点,题目难度中等.

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案| A. | 用手接触药品 | B. | 用嘴吹熄酒精灯火焰 | ||
| C. | 点燃氢气前一定要检验氢气的纯度 | D. | 将带有溶液的滴管平放在实验台上 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
①实验室制备Cl2的化学方程式为MnO2+4HCl(浓盐酸)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
②反应I的化学方程式为2NaOH+Cl2=NaCl+NaClO+H2O.
③湿法制备高铁酸盐的离子方程式为3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O.
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为高铁酸钾有强氧化性,能杀菌消毒,产生的Fe(OH)3胶体有吸附性,能吸附水中悬浮物质形成沉淀,从而净化水.
(3)干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为3:1.
(4)高铁电池是可充电电池,其反应为3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH.其正极的电极反应式为FeO42-+4H2O+3e-=Fe(OH)3+5OH-阴极的电极反应式为Zn(OH)2+2e-=Zn+2OH-
如图2为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有放电时间长,工作电压稳定.
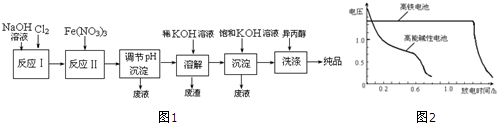
请根据实验步骤,回答下列问题:(已知:NaBr+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HBr)

(1)关闭K1和K2,接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷.竖直冷凝管的作用 是冷凝回流,使冷水从a(填a或b)处流入.
(2)写出A中发生反应的主要化学方程式:NaBr+H2SO4═HBr+NaHSO4、HBr+CH3CH2OH$\stackrel{△}{→}$CH3CH2Br+H2O
(3)理论上,上述反应的生成物还可能有:丁醚、1-丁烯、溴化氢、硫酸氢钠、水等.熄灭A处酒 精灯,在竖直冷凝管上方塞上塞子、打开K1,利用余热继续反应直至冷却,通过C、D装置检验
部分副产物,C、D中应盛放的试剂分别是硝酸银、高锰酸钾溶液或溴水,
观察到D瓶中的现象是溶液褪色
(4)相关有机物的数据如下:
| 物质 | 熔点/℃ | 沸点/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
(1)Cl2+2KI=2KCl+I2;
(2)2FeCl2+Cl2=2FeCl3;
(3)2FeCl3+2HI=2FeCl2+2HCl+I2,
(4)H2S+I2=S+2HI.
| A. | S>I2>Fe3+>Cl2 | B. | Cl2>Fe3+>I2>S | C. | Fe3+>Cl2>S>I2 | D. | Cl2>I2>Fe3+>S |