题目内容
18.纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用.如图所示的流程是制备纳米TiO2以及获得副产品绿矾的方法之一:
(1)FeSO4和Fe2(SO4)3的混合溶液中加入铁屑的目的是将Fe3+还原成Fe2+,除去Fe3+.
(2)检验绿矾晶体中是否含有Fe3+的实验操作是取少量晶体于试管中,加适量蒸馏水溶解,再加入1-2滴KSCN溶液,若不变红则无Fe3+,若变红则有Fe3+.
(3)TiOSO4水解生成H2TiO3的化学方程式为TiOSO4+2H2O=H2TiO3↓+H2SO4;水解生成的H2TiO3经过滤、洗涤等操作,再煅烧得到TiO2.
(4)为测得TiO2样品中TiO2的含量,常在一定条件下将TiO2溶解并还原为Ti3+以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.
①请写出滴定过程中反应的离子方程式:Ti3++Fe3+=Fe2++Ti4+、3SCN-+Fe3+=Fe(SCN)3;
②滴定终点的现象是滴入最后一滴NH4Fe(SO4)2标准溶液,锥形瓶内溶液刚好变红色且半分钟内颜色不发生变化;
③若滴定时,称取TiO2(摩尔质量为M g•mol-1)试样ωg,消耗c mol•L-1NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为$\frac{cVM}{10w}%$.
(5)TiO2与BaCO3在熔融状态下,可生成一种气体和一种半导体材料.该半导体材料的化学式为BaTiO3.
分析 磨碎的钛铁矿加入浓硫酸反应生成FeSO4、Fe2(SO4)3、TiOSO4、Ti(SO4)3,水溶过滤得到偏钛酸沉淀和滤液硫酸亚铁和硫酸铁混合溶液,偏钛酸分解生成二氧化钛,滤液中加入过量铁还原铁离子为亚铁离子,溶液浓缩蒸发,冷却结晶,过滤洗涤得到绿矾晶体,
(1)FeSO4和Fe2(SO4)3的混合溶液中加入铁屑还原铁离子为亚铁离子;
(2)依据铁离子遇到硫氰酸钾溶液变红色设计实验验证;
(3)TiOSO4水解生成H2TiO3和硫酸,过滤洗涤干燥灼烧得到二氧化钛;
(4)①滴定过程中发生的反应是用NH4Fe(SO4)2标准溶液中铁离子氧化性,滴定Ti3+至全部生成Ti4+,最后滴入一滴标准溶液变红色是铁离子和SCN-离子析出红色溶液;
②利用滴入的NH4Fe(SO4)2标准溶液中的铁离子,反应后结合SCN-形成红色溶液指示反应终点;
③依据滴定反应的定量关系计算;
(5)TiO2与BaCO3在熔融状态下,可生成一种气体和一种半导体材料,生成产物为BaTiO3和气体二氧化碳.
解答 解:(1)FeSO4和Fe2(SO4)3的混合溶液中加入铁屑还原铁离子为亚铁离子,除去Fe3+,发生的反应离子方程式为:2Fe3++Fe=3Fe2+,
故答案为:将Fe3+还原成Fe2+,除去Fe3+;
(2)依据铁离子遇到硫氰酸钾溶液变红色设计实验验证,检验绿矾晶体中是否含有Fe3+的实验操作是:取少量晶体于试管中,加适量蒸馏水溶解,再加入1-2滴KSCN溶液,若不变红则无Fe3+,若变红则有Fe3+,
故答案为:取少量晶体于试管中,加适量蒸馏水溶解,再加入1-2滴KSCN溶液,若不变红则无Fe3+,若变红则有Fe3+;
(3)TiOSO4水解生成H2TiO3和硫酸,反应的化学方程式为:TiOSO4+2H2O=H2TiO3↓+H2SO4 ,水解生成的H2TiO3经过滤、洗涤、干燥、灼烧得到二氧化钛,
故答案为:TiOSO4+2H2O=H2TiO3↓+H2SO4;过滤;洗涤;
(4)①滴定过程中发生的反应是用NH4Fe(SO4)2标准溶液中铁离子氧化性,滴定Ti3+至全部生成Ti4+,反应的离子方程式为:Ti3++Fe3+=Fe2++Ti4+,最后滴入一滴标准溶液变红色是铁离子和SCN-离子析出红色溶液,反应的离子方程式为:3SCN-+Fe3+=Fe(SCN)3,
故答案为:Ti3++Fe3+=Fe2++Ti4+;3SCN-+Fe3+=Fe(SCN)3;
②利用滴入的NH4Fe(SO4)2标准溶液中的铁离子,反应后结合SCN-形成红色溶液指示反应终点,滴定终点的现象是滴入最后一滴NH4Fe(SO4)2标准溶液,锥形瓶内溶液刚好变红色且半分钟内颜色不发生变化,
故答案为:滴入最后一滴NH4Fe(SO4)2标准溶液,锥形瓶内溶液刚好变红色且半分钟内颜色不发生变化;
③称取TiO2(摩尔质量为M g•mol-1)试样ωg,物质的量=$\frac{wg}{Mg/mol}$,消耗c mol•L-1NH4Fe(SO4)2标准溶液V mL,n(Fe3+)=cV×10-3mol,Ti3++Fe3+=Fe2++Ti4+,
依据滴定反应的定量关系可知,n(Fe3+)=n(Ti3+)=cV×10-3mol,则TiO2质量分数表达式=$\frac{cV×1{0}^{-3}mol×Mg/mol}{wg}$×100%=$\frac{cVM}{10w}%$,
故答案为:$\frac{cVM}{10w}%$;
(5)TiO2与BaCO3在熔融状态下,可生成一种气体和一种半导体材料,生成产物半导体材料为BaTiO3,气体为二氧化碳,故答案为:BaTiO3.
点评 本题考查了物质制备方法过程探究,物质性质和滴定实验测定分析应用,掌握基础是解题关键,题目难度中等.

 全优点练单元计划系列答案
全优点练单元计划系列答案| A. | 减压 | B. | 增加NH3的浓度 | C. | 升温 | D. | 及时移走产物 |
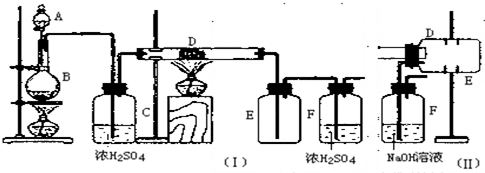
 1-溴异戊烷[(CH3)2CHCH2CH2Br]是有机合成的重要中间体,可用于生产染料、催化剂等,其沸点为121℃,易溶于CCl4,可由异戊醇与氢溴酸在硫酸催化作用下反应而得:(CH3)2CHCH2CH2OH+HBr$\stackrel{△}{→}$(CH3)2CHCH2CH2Br+H2O.已知异戊醇的沸点为132.5℃,微溶于水,易溶于CCl4.实验室制备1-溴异戊烷的装置如图所示.
1-溴异戊烷[(CH3)2CHCH2CH2Br]是有机合成的重要中间体,可用于生产染料、催化剂等,其沸点为121℃,易溶于CCl4,可由异戊醇与氢溴酸在硫酸催化作用下反应而得:(CH3)2CHCH2CH2OH+HBr$\stackrel{△}{→}$(CH3)2CHCH2CH2Br+H2O.已知异戊醇的沸点为132.5℃,微溶于水,易溶于CCl4.实验室制备1-溴异戊烷的装置如图所示.请回答下列问题:
(1)上述实验装置中长导管的作用是冷凝回流;导管末端插入CCl4中而不直接插入水中,除了能将挥发出的Br2、1-溴异戊烷等充分吸收外,另一个重要作用是防止倒吸.
(2)将1-溴异戊烷的粗产品置于分液漏斗中加水,振荡后静置,有机物将在下层(填“在上层”、“在下层”或“不分层”).
(3)在制备过程中,Br-可被氧化为Br2而引入杂质.欲除去Br2,可选用CE(填字母).
A.NaI B.NaOH C.NaHSO3 D.KCl E.NaHCO3
(4)在制备1-溴异戊烷时,不能边反应边蒸出产物,其原因是1-溴丁烷与正丁醇的沸点差较小,若边反应边蒸出产物,会有较多的正丁醇挥发,降低原料的利用率.
(5)在实验室中还可用NaBr、浓H2SO4和异戊醇为原料制备1-溴异戊烷.已知反应物的用量如下表:
| 反应物 | NaBr | 98.3% 浓H2SO4 | 异戊醇 | 水 |
| 用量 | 0.30mol | 35mL(过量) | 0.25mol | 30mL |
| A. | 在利用重结晶的方法制备KNO3的过程中,可在漏斗中加入酒精来洗涤 | |
| B. | 在石油的分馏实验中,冷凝管中冷水应从上口进入,热水从下口流出 | |
| C. | 粗盐提纯中,在溶解粗盐时,应用大量的水来溶解,以防止食盐不完全溶解 | |
| D. | 在分液实验中,待液体静置分层后,上、下层液体都应分别从分液漏斗下端的活塞放出 |