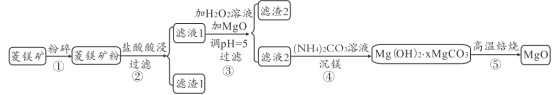
题目内容
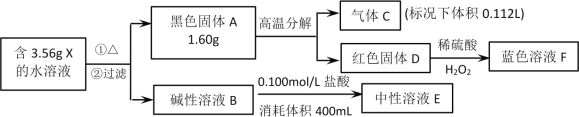
【题目】I.由四种常见元素组成的化合物X,按如下流程进行实验。气体C能使带火星木条复燃,溶液B和溶液E的焰色反应为黄色,固体A和D组成元素相同。
请回答:
(1)X 的化学式__________________。
(2)X可由蓝色溶液F与过量的浓的B溶液反应获得,写出该反应的离子方程式_____________。
(3)黑色固体A可在高温下与氨气作用生成红色固体D,同时生成一种单质,写出该反应的方程式________________________________________。
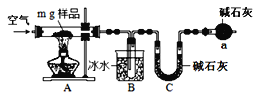
II.为测定碳酸钠和碳酸氢钠混合样品中碳酸钠的质量分数,可通过加热分解得到的CO2质量进行计算。某同学设计的实验装置示意图如下:
请回答:
(1)仪器a的作用是________________________________________。
(2)指出该同学设计的实验装置存在的缺陷__________________________________。
(3)设计实验方案说明样品中碳酸氢钠已经分解完全_________________________。
【答案】Na2[Cu(OH)4] Cu2++4OH-=[Cu(OH)4]2- 6CuO+2NH3![]() 3Cu2O+N2+3H2O 防止空气中的CO2和H2O进入C中,影响CO2的质量测定 空气中的CO2和H2O,直接通入空气影响CO2的质量测定(或B和C之间缺少吸收水蒸汽的装置,影响CO2的质量测定) 持续加热后称量硬质玻璃管或C,若质量不再改变,则说明固体已经分解完全
3Cu2O+N2+3H2O 防止空气中的CO2和H2O进入C中,影响CO2的质量测定 空气中的CO2和H2O,直接通入空气影响CO2的质量测定(或B和C之间缺少吸收水蒸汽的装置,影响CO2的质量测定) 持续加热后称量硬质玻璃管或C,若质量不再改变,则说明固体已经分解完全
【解析】
I.气体C能使带火星木条复燃,应为O2,且n(O2)=0.112L÷22.4L/mol=0.005mol,红色固体与稀硫酸、过氧化氢反应得到蓝色溶液,固体A和D组成元素相同,则D为Cu2O,可知A为CuO,发生4CuO![]() 2Cu2O+O2↑,可知n(CuO)=1.60g÷80g/mol=0.02mol,溶液B和溶液E的焰色反应为黄色,说明含有钠元素,碱性溶液B与0.100mol/L400mL盐酸反应,B为NaOH水溶液,且n(NaOH)=0.04mol,X可由蓝色溶液F与过量的浓的B溶液反应获得,且满足n(Cu):n(Na)=1:2,应为Na2[Cu(OH)4],则
2Cu2O+O2↑,可知n(CuO)=1.60g÷80g/mol=0.02mol,溶液B和溶液E的焰色反应为黄色,说明含有钠元素,碱性溶液B与0.100mol/L400mL盐酸反应,B为NaOH水溶液,且n(NaOH)=0.04mol,X可由蓝色溶液F与过量的浓的B溶液反应获得,且满足n(Cu):n(Na)=1:2,应为Na2[Cu(OH)4],则
(1)X为Na2[Cu(OH)4],故答案为:Na2[Cu(OH)4];
(2)结合原子守恒、电荷守恒可写出CuSO4溶液和浓NaOH反应生成X的离子方程式为:Cu2++4OH-=[Cu(OH)4]2-,故答案为:Cu2++4OH-=[Cu(OH)4]2-;
(3)CuO中的Cu为+2价,有氧化性,CuO作氧化剂,还原产物为Cu2O,NH3中的N为-3价,有还原性,NH3作还原剂,还原产物为N2,二者发生氧化还原反应的方程式为:6CuO+2NH3![]() 3Cu2O+N2+3H2O,故答案为:6CuO+2NH3
3Cu2O+N2+3H2O,故答案为:6CuO+2NH3![]() 3Cu2O+N2+3H2O;
3Cu2O+N2+3H2O;
Ⅱ.(1)NaHCO3在A中加热分解生成碳酸钠、水蒸汽和二氧化碳,水蒸气在B中冷凝,二氧化碳在C中被吸收,C中质量的增大量为二氧化碳的质量,从而计算碳酸氢钠的质量和质量分数,因此a的作用是防止空气中的CO2和H2O进入C中,影响CO2的质量测定,故答案为:防止空气中的CO2和H2O进入C中,影响CO2的质量测定;
(2)一方面,空气中有CO2和H2O,直接通入空气影响CO2的质量测定,可改成通入N2,另一方面,B和C之间缺少吸收水蒸汽的装置,水蒸汽也能被C吸收,影响CO2的质量测定,故答案为:空气中的CO2和H2O,直接通入空气影响CO2的质量测定(或B和C之间缺少吸收水蒸汽的装置,影响CO2的质量测定);
(3)如果碳酸氢钠已经完全分解,则A中硬质玻璃管质量将不再减小,C的质量将不再增大,所以,可通过称量装置A中的硬质玻璃管或者C的质量,若硬质玻璃管或者C的质量不再改变,则说明碳酸氢钠已完全分解,故答案为:持续加热后称量硬质玻璃管或C,若质量不再改变,则说明固体已经分解完全。