题目内容
在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g) nY(g) ΔH=QkJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示,下列说法正确的是
nY(g) ΔH=QkJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示,下列说法正确的是
| 容器体积/L c(Y)/mol/L 温度/℃ | 1 | 2 | 3 |
| 100 | 1.00 | 0.75 | 0.53 |
| 200 | 1.20 | 0.90 | 0.63 |
| 300 | 1.30 | 1.00 | 0.70 |
A.m>n B.温度不变,压强增大,Y的质量分数减少
C.Q<0 D.体积不变,温度升高,平衡向逆反应方向移动
B
解析试题分析:从图中可以看出,在温度不变的条件下,增大体积,平衡正向移动,表明正向是体积增大的方向,也就是说:m<n ,A错误;在体积不变的条件下,升高温度,平衡也是正向移动,即正向是吸热的方向,因此有:Q>0,C、D错误;只有B正确。
考点:平衡移动的有关知识。

练习册系列答案
相关题目
对于可逆反应2HI(g)  I2(g)+H2(g),下列叙述能够说明已达到平衡状态的是
I2(g)+H2(g),下列叙述能够说明已达到平衡状态的是
| A.各物质的量的浓度比2 : 1 : 1 |
| B.容器内的总压不随时间变化 |
| C.断裂2 mol H-I键的同时生成1 mol I-I键 |
| D.混合气体的颜色不再变化时 |
下列各表述与示意图一致的是
A.图①表示N2O4(g) 2NO2(g) ΔH>0,N2O4转化率随温度、时间的变化 2NO2(g) ΔH>0,N2O4转化率随温度、时间的变化 |
B.图②中曲线表示反应2SO2(g)+O2(g) 2SO3(g) ΔH<0,正、逆反应的平衡常数K随温度的变化 2SO3(g) ΔH<0,正、逆反应的平衡常数K随温度的变化 |
| C.图③表示10 mL0.01 mol/LKMnO4酸性溶液与过量0.1mol/LH2C2O4溶液混合时,n(Mn2+)随时间的变化 |
| D.图④中a、b曲线分别表示反应CH2=CH2(g)+H2(g) |
向一恒容密闭容器中充入2 mol SO2和1mol O2,在一定条件下发生反应:
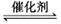
 ,下列有关说法正确的是( )
,下列有关说法正确的是( )
| A.达到化学平衡时,正反应和逆反应的速率都为零 |
| B.当O2的浓度不变时,反应达到平衡状态 |
| C.当单位时间消耗a mol O2,同时消耗2a mol SO2时,反应达到平衡状态 |
| D.当SO2、O2、SO3的分子数比为2:1:2,反应达到平衡状态 |
在温度、容积相同的三个密闭容器中发生反应N2(g) + 3H2(g) 2NH3(g) ΔH= -92.4kJ/mol,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
2NH3(g) ΔH= -92.4kJ/mol,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 |
| NH3的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| 体系压强 | P1 | P2 | P3 |
| 反应物转化率 | α1 | α2 | α3 |
下列说法正确的是
A.2 c1>c3 B.a + b=92.4 C.2P1<P3 D.α1 +α3=1
实验室用锌粒与VmL浓度为10%的稀硫酸反应制取氢气,若向反应混合物中加入下列物质,关于反应速率v说法正确的是
| A.少量Na2SO4固体,v(H2)减小 | B.VmLBaCl2溶液,v(H2)不变 |
| C.加入细小的碳粒,v(H2)增大 | D.加入NH4HSO4固体,v(H2)不变 |
一定温度下,在2L密闭容器中发生下列反应:4NO2(g)+O2(g) 2N2O5(g);已知该反应的平衡常数:
2N2O5(g);已知该反应的平衡常数: >
> ,且体系中
,且体系中 (单位:mol)随时间变化如下表:
(单位:mol)随时间变化如下表:
| 时间(s) | 0 | 500 | 1000 | 1500 |
| t1℃ | 20 | 13.96 | 10.08 | 10.08 |
| t2℃ | 20 | a | b | c |
下列说法一定正确的是
A.正反应为吸热反应
B.如果t2℃<t1℃,那么a>b=c,且a=10+0.5b
C.如果t2℃<t1℃,那么t2℃达到平衡的时间介于1000s至1500s之间
D.如果t2℃>t1℃,那么b>10.08
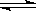 C(g)+3D(g),现从两条途径分别建立平衡。途径Ⅰ:A、B的起始浓度均为2mol/L;途径Ⅱ:C、D的起始浓度分别为2 mol/L和6mol/L。则以下叙述不正确的是
C(g)+3D(g),现从两条途径分别建立平衡。途径Ⅰ:A、B的起始浓度均为2mol/L;途径Ⅱ:C、D的起始浓度分别为2 mol/L和6mol/L。则以下叙述不正确的是