题目内容
在温度、容积相同的三个密闭容器中发生反应N2(g) + 3H2(g) 2NH3(g) ΔH= -92.4kJ/mol,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
2NH3(g) ΔH= -92.4kJ/mol,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 |
| NH3的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| 体系压强 | P1 | P2 | P3 |
| 反应物转化率 | α1 | α2 | α3 |
下列说法正确的是
A.2 c1>c3 B.a + b=92.4 C.2P1<P3 D.α1 +α3=1
B
解析试题分析:A、丙可以看作是两个甲容器平衡后再放入同一个容器中,若平衡不移动,则有2 c1=c3,但是放入同一个容器中后,平衡正向移动,导致2 c1<c3,错误;B、从二个方向开始的反应达到平衡时,应该有a + b=92.4,正确;C、因为是同温同体积的条件,所以压强比等于物质的量的比,丙的情况可以理解为两个甲分别达到平衡后再充在一个容器中,假如平衡不移动,则压强正好是二倍,但是随着压强的增大,平衡正向移动,导致物质的量减少,所以有2P1>P3错误;D、在反应容器甲中,反应物是氮气和氢气,在反应容器乙中,反应物是氨气,达到平衡时有α1 +α2=1,但对于丙容器来讲,相当于乙中的反应物的二倍,转化是降低的,也就是说α2>α3,因此有α1 +α3<1,错误。
考点:化学的有关知识。

下列事实不能用勒夏特列原理解释的是
| A.开启啤酒瓶后,瓶中马上泛起大量泡沫 |
| B.H2、I2、HI混合气体加压后颜色变深 |
| C.红棕色的NO2加压后颜色先变深再变浅 |
| D.工业上生产硫酸的过程中使用过量的空气,以提高二氧化硫的利用率 |
今有X(g)+Y(g)  2Z(g) △H<0。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,引起t2→t3曲线变化的原因是
2Z(g) △H<0。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,引起t2→t3曲线变化的原因是
| A.增大X或Y的浓度 | B.增大压强 |
| C.增大Z的浓度 | D.升高温度 |
在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g) nY(g) ΔH=QkJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示,下列说法正确的是
nY(g) ΔH=QkJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示,下列说法正确的是
| 容器体积/L c(Y)/mol/L 温度/℃ | 1 | 2 | 3 |
| 100 | 1.00 | 0.75 | 0.53 |
| 200 | 1.20 | 0.90 | 0.63 |
| 300 | 1.30 | 1.00 | 0.70 |
A.m>n B.温度不变,压强增大,Y的质量分数减少
C.Q<0 D.体积不变,温度升高,平衡向逆反应方向移动
某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)  ?2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如下图所示:
?2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如下图所示: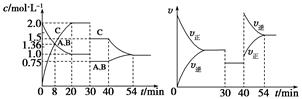
下列说法中正确的是( )
| A.30~40 min间该反应使用了催化剂 |
| B.反应方程式中的x=1,正反应为吸热反应 |
| C.30 min时降低温度,40 min时升高温度 |
| D.8 min前A的平均反应速率为0.08 mol·L-1·min-1 |
温度压强一定,在催化剂铁触媒作用下,向一密闭容器充入N2、H2和NH3 。若起始时n(N2)="x" mol、n(H2)="y" mol、n(NH3)="z" mol (x、y、z均不为0 ),平衡时n(N2)=0.1mol、n(H2)=0.3mol、n(NH3)=0.08mol。下列有关判断不合理的是:
| A.N2、H2的转化率不相等 | B.平衡时,H2与NH3的生成速率之比为3:2 |
| C.x : y =1:3 | D.x的取值范围为0<x<0.14 |
在一定条件下,对于密闭容器中进行的可逆反应A(g)+3B(g)
|
B.A、B、C的浓度相等
C.单位时间生成 n mol A,同时生成 3n mol B
D.生成C的速率与C分解的速率相等
 zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是

 pC达到平衡,若:
pC达到平衡,若: