��Ŀ����
�ں��¡����ݵ������£��з�Ӧ2A��g����2B��g��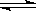 C��g����3D��g�����ִ�����;���ֱ���ƽ�⡣;����A��B����ʼŨ�Ⱦ�Ϊ2mol/L��;����C��D����ʼŨ�ȷֱ�Ϊ2 mol/L��6mol/L����������������ȷ����
C��g����3D��g�����ִ�����;���ֱ���ƽ�⡣;����A��B����ʼŨ�Ⱦ�Ϊ2mol/L��;����C��D����ʼŨ�ȷֱ�Ϊ2 mol/L��6mol/L����������������ȷ����
A.��;�����մﵽƽ��ʱ����ϵ�ڻ������ƽ����Է���������ͬ
B.��;�����մﵽƽ��ʱ����ϵ�ڻ�����İٷ������ͬ
C.��ƽ��ʱ��;����ķ�Ӧ����v��A��С��;����ķ�Ӧ����v��A��
D.��ƽ��ʱ��;�������û�������ܶ�Ϊ;�������û�����ܶȵ�1/2
A
��������������ɷ�Ӧ2A��g����2B��g��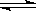 C��g����3D��g����֪�������������������ȫת��ΪA��Bʱ��������4molA��4molB��������ʵ�����ֵ��ȡ����ڷ�Ӧǰ������Ļ�ѧ��������ȣ�ѹǿ��ƽ���ƶ�û��Ӱ�죬��˵���ﵽƽ��״̬ʱ��;��I�е�ƽ��״̬�ǵ�Ч�ģ�����Ϊ��Чƽ��״̬����ϵ�ڻ������İٷ������ͬ���������ƽ����Է���������ͬ���������������ȣ������������Ǣ�����������2������ﵽƽ��ʱ��;����������ܶ�Ϊ;�����ܶȵ�
C��g����3D��g����֪�������������������ȫת��ΪA��Bʱ��������4molA��4molB��������ʵ�����ֵ��ȡ����ڷ�Ӧǰ������Ļ�ѧ��������ȣ�ѹǿ��ƽ���ƶ�û��Ӱ�죬��˵���ﵽƽ��״̬ʱ��;��I�е�ƽ��״̬�ǵ�Ч�ģ�����Ϊ��Чƽ��״̬����ϵ�ڻ������İٷ������ͬ���������ƽ����Է���������ͬ���������������ȣ������������Ǣ�����������2������ﵽƽ��ʱ��;����������ܶ�Ϊ;�����ܶȵ�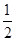 ����ѡ��B��D��ȷ��A����;��������Ũ�ȴ�Ӧ���ʿ죬���ѡ��C��ȷ����ѡA��
����ѡ��B��D��ȷ��A����;��������Ũ�ȴ�Ӧ���ʿ죬���ѡ��C��ȷ����ѡA��
���㣺�����Чƽ����жϡ�Ӧ��

���б仯�����У���S��0����
| A���Ȼ�������ˮ�� | B��NH3(g)��HCl(g)��Ӧ����NH4Cl |
| C���ɱ������� | D��CaCO3(S)�ֽ�ΪCaO(S)��CO2(g) |
��ѧƽ�ⳣ��K����ֵ��С�Ǻ�����ѧ��Ӧ���г̶ȵı�־���ڳ����£����з�Ӧ��ƽ�ⳣ������ֵ���£�2NO��g�� N2��g����O2��g�� K1��1��1030
N2��g����O2��g�� K1��1��1030
2H2��g����O2��g�� 2H2O��g�� K2��2��1081
2H2O��g�� K2��2��1081
2CO2��g�� 2CO��g����O2��g�� K3��4��10��92
2CO��g����O2��g�� K3��4��10��92
����˵����ȷ���� �� ��
| A�������£�NO�ֽ����O2�ķ�Ӧ��ƽ�ⳣ������ʽΪK1��c��N2����c��O2�� |
| B�������£�ˮ�ֽ����O2����ʱƽ�ⳣ������ֵԼΪ5��10��80 |
| C�������£�NO��H2O��CO2���ֻ�����ֽ�ų�O2�������ɴ�С��˳��ΪNO��H2O��CO2 |
| D������˵��������ȷ |
����X��g��+Y(g)  2Z(g) ��H��0���ӷ�Ӧ��ʼ����t1��ﵽƽ��״̬��t2ʱ���������ı䣬ƽ���ܵ��ƻ�����t3ʱ�ִﵽƽ�⣬����t2��t3���߱仯��ԭ����
2Z(g) ��H��0���ӷ�Ӧ��ʼ����t1��ﵽƽ��״̬��t2ʱ���������ı䣬ƽ���ܵ��ƻ�����t3ʱ�ִﵽƽ�⣬����t2��t3���߱仯��ԭ����
| A������X��Y��Ũ�� | B������ѹǿ |
| C������Z��Ũ�� | D�������¶� |
��һ����ɱ���ܱ������У�����һ������X��Y��������ӦmX(g) nY(g) ��H=QkJ/mol����Ӧ�ﵽƽ��ʱ��Y�����ʵ���Ũ�����¶ȡ���������Ĺ�ϵ���±���ʾ������˵����ȷ����
nY(g) ��H=QkJ/mol����Ӧ�ﵽƽ��ʱ��Y�����ʵ���Ũ�����¶ȡ���������Ĺ�ϵ���±���ʾ������˵����ȷ����
| �������/L c(Y)/mol/L �¶�/�� | 1 | 2 | 3 |
| 100 | 1.00 | 0.75 | 0.53 |
| 200 | 1.20 | 0.90 | 0.63 |
| 300 | 1.30 | 1.00 | 0.70 |
A��m��n B���¶Ȳ��䣬ѹǿ����Y��������������
C��Q��0 D��������䣬�¶����ߣ�ƽ�����淴Ӧ�����ƶ�
�¶�ѹǿһ�����ڴ�������ý�����£���һ�ܱ���������N2��H2��NH3 ������ʼʱn(N2)="x" mol��n(H2)="y" mol��n(NH3)="z" mol (x��y��z����Ϊ0 )��ƽ��ʱn(N2)=0.1mol��n(H2)=0.3mol��n(NH3)=0.08mol�������й��жϲ��������ǣ�
| A��N2��H2��ת���ʲ���� | B��ƽ��ʱ��H2��NH3����������֮��Ϊ3:2 |
| C��x : y =1:3 | D��x��ȡֵ��ΧΪ0��x��0.14 |
һ�������£��ݻ�Ϊ2 L���ܱ������У�ͨ��2 mol N2��3 mol H2���з�ӦN2(g)��3H2(g)  2NH3(g)��20 min��N2�����ʵ���Ϊ1.9 mol��1 h���������������ѹǿ���ٸı䣬��Ϊ��Ӧ��ʼʱѹǿ��0.8����������������ȷ���ǣ� ��
2NH3(g)��20 min��N2�����ʵ���Ϊ1.9 mol��1 h���������������ѹǿ���ٸı䣬��Ϊ��Ӧ��ʼʱѹǿ��0.8����������������ȷ���ǣ� ��
| A��1 h��Ӧ������ȫ�������е�N2Ũ��Ϊ0.55 mol��L��1 |
| B��ǰ20 min��NH3��ʾ�ķ�Ӧ����Ϊ0.01 mol��L��1��min��1 |
| C������H2��Ũ�Ȼ��¶ȣ�ƽ�⽫������Ӧ�����ƶ����ҷ�Ӧ���ʾ��ӿ� |
| D����������ѹǿ���ı�ʱ��˵����Ӧ�Ѵﵽƽ��״̬ |
 2HI(g)��ƽ�ⳣ����49����HI(g)
2HI(g)��ƽ�ⳣ����49����HI(g)
 H2(g)+
H2(g)+ 
