题目内容
16.元素周期表中,同主族元素从上到下,原子半径逐渐增大(填“增大”或“减小”),元素的金属性逐渐增强(填“增强”或“减弱”),非金属性逐渐减弱(填“增强”或“减弱”);同周期从左到右,原子半径逐渐减小(填“增大”或“减小”),元素的金属性逐渐减弱(填“增强”或“减弱”),非金属性逐渐增强(填“增强”或“减弱”).分析 同一主族从上到下原子半径增大,元素的金属性逐渐增强,非金属性逐渐减弱;同一周期从左到右,原子半径减小,元素的非金属性逐渐增强,金属性逐渐减弱,以此解答该题.
解答 解:同一主族从上到下,原子核外电子层数逐渐增多,则原子半径逐渐增大,原子核对最外层电子的吸引能力减弱,则元素的金属性逐渐增强,非金属性逐渐减弱;
同一周期从左到右,电子层数相同,质子数增多,原子半径减小,元素的非金属性逐渐增强,金属性逐渐减弱;
故答案为:增大;增强;减弱;减小;减弱;增强.
点评 本题考查元素周期律、周期表知识,侧重于基本规律的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目
6.下列不能说明氯元素的非金属性比硫元素强的事实( )
| A. | 氯化氢比硫化氢稳定 | B. | 次氯酸的氧化性比硫酸强 | ||
| C. | 高氯酸的酸性比硫酸的强 | D. | 氯气能与硫化氢反应生成硫 |
4.下列溶液混合后,常温下溶液一定呈碱性的是( )
| A. | pH=12的氢氧化钠溶液与pH=2的某酸溶液等体积混合 | |
| B. | pH=2的某酸溶液与pH=12某碱溶液等体积混合 | |
| C. | pH=2的盐酸pH=12的氨水等体积混合 | |
| D. | 1×10-3mol/L的盐酸和6×10-4mol/L的Ba(OH)2溶液各取10mL,混合后再稀释100倍 |
11.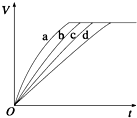 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( ) | 组别 | 对应曲线 | c(HCl)/mol•L-1 | 反应温度/℃ | 铁的状态 |
| 1 | a | 30 | 粉末状 | |
| 2 | b | 30 | 粉末状 | |
| 3 | c | 2.5 | 块状 | |
| 4 | d | 2.5 | 30 | 块状 |
| A. | 第4组实验的反应速率最慢 | |
| B. | 第1组实验中盐酸的浓度大于2.5 mol•L-1 | |
| C. | 第2组实验中盐酸的浓度等于2.5 mol•L-1 | |
| D. | 第3组实验的反应温度低于30℃ |
8.金刚石和石墨是碳元素的两种常见单质,下列叙述中正确的有 ( )
| A. | 金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化 | |
| B. | 晶体中共价键的键长:金刚石中C-C<石墨中C-C | |
| C. | 晶体的熔点:金刚石<石墨 | |
| D. | 晶体中共价键的键角:金刚石>石墨. |
6.NA代表阿伏伽德罗常数的值,已知C2H4和C3H6的混合物的质量为ag,则该混合物( )
| A. | 所含共用电子对数为($\frac{a}{7}+1$)NA | B. | 所含碳氢键数目为$\frac{a{N}_{A}}{7}$ | ||
| C. | 燃烧时消耗的O2一定是$\frac{33.6a}{14}$L | D. | 所含原子总数为$\frac{a{N}_{A}}{14}$ |

 (写出其结构简式).
(写出其结构简式). .
. .
. )的酸酐,它可以经下列变化分别得到苹果酸(
)的酸酐,它可以经下列变化分别得到苹果酸( )和聚合物Q:
)和聚合物Q:
 .
. .
. .
.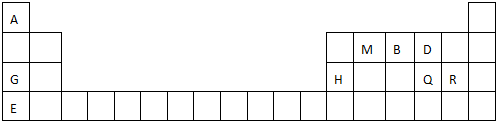

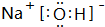 ; 用电子式表示G与Q形成化合物的过程
; 用电子式表示G与Q形成化合物的过程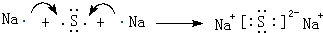 ;
;