题目内容
【题目】反应8NH3+3Cl2→N2+6NH4Cl的相关描述中正确的是
A.N2的电子式是 ![]()
B.反应物和生成物的化学键类型相同
C.每生成11.2 L N2,转移电子数为3 NA
D.还原剂与还原产物的物质的量之比是1∶3
【答案】D
【解析】
A.氮气的电子式为:![]() ;
;
B.反应物氨气和氯气均只含有共价键,生成物NH4Cl中铵根和氯离子直接为离子键,故B错误;
C.未指明温度和压强,无法确定11.2 L N2的物质的量,无法确定转移电子数,故C错误;
D. 反应中NH3为还原剂,NH4Cl为还原产物,由方程式可知,当有8molNH3参加反应,有2mol被氧化,生成6molNH4Cl,则该反应中还原剂与还原产物的物质的量之比是1∶3,故D正确;
故答案为D。

 名校课堂系列答案
名校课堂系列答案【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据:
苯 | 溴 | 溴苯 | |
密度/g·cm﹣3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
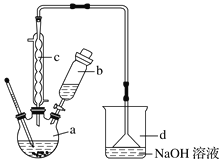
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑,在b中小心加入4.0mL液态溴,向a中滴入几滴溴,有白色烟雾产生,是因为生成了_______气体,继续滴加液溴滴完。铁屑的作用是___________;a中发生的化学反应方程式______________________。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。NaOH溶液洗涤的作用是____;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是_______;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,下列操作中必须的是______(填入正确选项前的字母);
A.重结晶B.过滤C.蒸馏D.萃取
(4)在该实验中,a的容积最适合的是_______(填入正确选项前的字母)。
A.25mL B.50mL C.250mL D.500mL