题目内容
【题目】Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别是__、__(填标号)。
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(2)r(Li+)__r(H-),原因是___。
(3)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是__。中心原子的杂化形式为___。LiAlH4中,存在__(填标号)。
A.离子键 B.σ键 C.π键 D.氢键
(4)Li2O是离子晶体,其晶格能可通过图a的BornHaber循环计算得到。
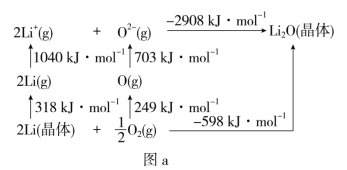
可知,Li原子的第一电离能为__kJ·mol-1,O=O键键能为__kJ·mol-1,Li2O晶格能为__kJ·mol-1。
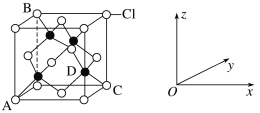
(5)Li2O具有反萤石结构,晶胞如图b所示,已知晶胞参数为0.4665nm,阿伏加德罗常数的值为NA,则Li2O的密度为___g·cm-3(列出计算式)。

【答案】D C < H-核电荷数更小 正四面体形 sp3 AB 520 498 2908 ![]()
【解析】
(1)根据构造原理和核外电子排布规律分析;
(2)电子层结构相同的离子,离子核电荷数越大,其吸引电子能力越大;
(3)根据价层电子对互斥理论分析微粒空间结构及轨道杂化类型;
(4)根据第一电离能、晶格能、键能的概念及图示转化关系分析解答;
(5)根据晶胞结构运用分摊法计算晶胞中原子数目,根据![]() 进行计算。
进行计算。
(1)根据构造原理,各能级的能量由低到高的顺序为1s<2s<2p<3s,根据图知,能量最低的是D、能量最高的是C,故答案为:D、C;
(2)Li+与H-具有相同的电子层结构,离子核电荷数:Li+>H-,其吸引电子能力:Li+>H-,导致其半径越小r(Li+)<r(H-),故答案为:<;H-核电荷数更小;
(3)LiAlH4中的阴离子中Al原子价层电子对个数=4+![]() =4,且不含孤电子对,根据价层电子对互斥理论判断其空间构型及中心原子杂化方式分别为正四面体形、sp3杂化;LiAlH4中,阴阳离子之间存在离子键、Al和H原子之间存在极性共价单键,所以含有的化学键为离子键、σ键,故答案为:正四面体;sp3;AB;
=4,且不含孤电子对,根据价层电子对互斥理论判断其空间构型及中心原子杂化方式分别为正四面体形、sp3杂化;LiAlH4中,阴阳离子之间存在离子键、Al和H原子之间存在极性共价单键,所以含有的化学键为离子键、σ键,故答案为:正四面体;sp3;AB;
(4)Li原子的第一电离能为气态基态Li原子失去1个电子所需要的能量,所以其第一电离能为![]() kJ/mol=520kJ/mol;O=O键键能为氧气分子变为气态氧原子所需能量,其键能=2×249kJ/mol=498kJ/mol;晶格能是气态离子形成1mol离子晶体释放的能量,所以其晶格能为2908kJ/mol,故答案为:520;498;2908;
kJ/mol=520kJ/mol;O=O键键能为氧气分子变为气态氧原子所需能量,其键能=2×249kJ/mol=498kJ/mol;晶格能是气态离子形成1mol离子晶体释放的能量,所以其晶格能为2908kJ/mol,故答案为:520;498;2908;
(5)晶胞中Li+个数是8、O2-个数=![]() ,晶胞体积=(0.4665×10-7cm)3,晶胞密度=
,晶胞体积=(0.4665×10-7cm)3,晶胞密度=![]() g/cm3,故答案为:
g/cm3,故答案为:![]() 。
。

 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案【题目】工业上“固定”和利用CO2能有效地减轻“温室效应”。
I.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-49.0kJmol﹣1,某科学实验将6molCO2和8 molH2充入一容积为2L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标):
CH3OH(g)+H2O(g) △H=-49.0kJmol﹣1,某科学实验将6molCO2和8 molH2充入一容积为2L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标):
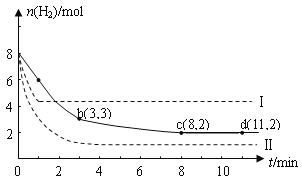
回答下列问题:
(1)以下说法不正确的是(__________)
A.0~1min的平均反应速率大于3~4min的平均反应速率
B.达到平衡时H2的转化率为75%
C. 在其它条件不变时,若提高反应的温度正反应速率增大,逆反应速率减小
(2)该反应在0 ~8 min内CO2的平均反应速率是_______。
(3)该反应的平街常数K=______________。
(4)仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比,虚线I改变的条件可能是_________。若实线对应条件下平衡常数为K,虚线I对应条件下平衡常数为K1,虚线II对应条件下平衡常数为K2,则K、K1和K2的大小关系是____。
II.己知25℃时,乙酸和碳酸的电离平衡常数如下表:
物质的化学式 | CH3COOH | H2CO3 | |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 | K2=5.6×10-11 |
(1)用饱和氨水吸收CO2可得到NH4HCO3溶液,若已知CH3COONH4溶液pH=7,则(NH4)2CO3溶液显_____(填“酸性”、“碱性”或“中性”)。
(2)25℃时,在0.lmolL﹣1乙酸溶液中加入一定量的NaHCO3,保持温度不变,所得混合液的pH=6,那么混合液中![]() =_______;该混合溶液中的离子浓度由大到小的顺序为:________________。
=_______;该混合溶液中的离子浓度由大到小的顺序为:________________。