题目内容
(8分)某课外活动小组用下图进行实验,试回答下列问题。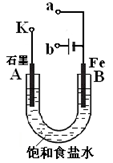
(1)若开始时开关K与a连接,则B极的电极反应式为 ;
(2)若开始时开关K与b连接,则B极的电极反应式为 ;
总反应的离子方程式为 ;
(3)当开关K与b连接时,下列说法正确的是(填序号) 。
①溶液中Na+向B极移动
②从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
③反应一段时间后加入适量的盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24L气体,则溶液中转移了0.2mol电子
(1)Fe-2e-= Fe2+。
(2)2H++2e-= H2↑(或写成2H2O +2e-=H2↑+2OH-)2Cl-+2H2O 2OH-+H2↑+Cl2↑;
2OH-+H2↑+Cl2↑;
(3)①②
解析试题分析:(1)若开始时开关K与a连接,则构成原电池,由于活动性Fe>C,所以B极是负极,B电极反应式为Fe-2e-=Fe2+。(2)若开始时开关K与b连接,则构成电解池,由于B与电源的负极连接,所以B极是阴极,在B电极发生还原反应,因为放电能力:H+>Na+,因此B电极反应式为2H++2e-= H2↑; 该电池的总反应的离子方程式为2Cl-+2H2O 2OH-+H2↑+Cl2↑;(3)当开关K与b连接时,构成的是电解池,根据同种电荷相互排斥,异种电荷相互吸引的原则,①溶液中Na+向负电荷较多的B极移动,正确;②在A电极,溶液中的Cl-放电产生氯气从A极处逸出,由于其有强氧化性,能够把KI中的碘元素氧化为I2,I2遇淀粉而变为蓝色,因此看到湿润的KI淀粉试纸变蓝,正确;③反应一段时间后由于逸出了氢气和氯气,若向溶液中加入HCl可恢复至反应前的浓度,若加入适量的盐酸,由于其中含有水,所以不能恢复到电解前电解质的浓度,错误;④若标准状况下B极产生2.24L气体,则在外电路中转移了0.2mol电子,在溶液中则是离子定向移动,错误。
2OH-+H2↑+Cl2↑;(3)当开关K与b连接时,构成的是电解池,根据同种电荷相互排斥,异种电荷相互吸引的原则,①溶液中Na+向负电荷较多的B极移动,正确;②在A电极,溶液中的Cl-放电产生氯气从A极处逸出,由于其有强氧化性,能够把KI中的碘元素氧化为I2,I2遇淀粉而变为蓝色,因此看到湿润的KI淀粉试纸变蓝,正确;③反应一段时间后由于逸出了氢气和氯气,若向溶液中加入HCl可恢复至反应前的浓度,若加入适量的盐酸,由于其中含有水,所以不能恢复到电解前电解质的浓度,错误;④若标准状况下B极产生2.24L气体,则在外电路中转移了0.2mol电子,在溶液中则是离子定向移动,错误。
考点:考查原电池、电解池的反应原理及应用的知识。

 阅读快车系列答案
阅读快车系列答案下图所示各种装置中能构成原电池的是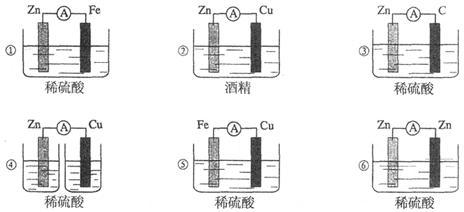
| A.①②③ | B.④⑤⑥ |
| C.①③⑤ | D.②④⑥ |
用铂电极(惰性)电解下列溶液时,阴极和阳极上的主要产物分别是H2和O2的是( )
| A.稀NaOH溶液 | B.HCl溶液 | C.NaCl溶液 | D.酸性AgNO3溶液 |
以惰性电极电解一定浓度的CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1mol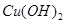 ,恰好恢复到电解前的pH和浓度,则电解过程中转移的电子的物质的量为:
,恰好恢复到电解前的pH和浓度,则电解过程中转移的电子的物质的量为:
| A.0.1mol | B.0.2mol | C.0.3mol | D.0.4mol |
(11分)
(1)海水中的钠盐、镁盐等都是重要的化工原料,从海水中提取铀、重水对一个国家来说具有战略意义。
①写出氯化镁的电子式__________________________
②重水的摩尔质量为____________________________
③写出金属镁的工业冶炼方程式__________________________________________
④海水淡化的常见方法有电渗析法、离子交换法、_________________
(2)比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射氯乙烷(沸点12.27℃)进行局部冷冻麻醉应急处理。
①乙烯和氯化氢在一定条件下反应的化学方程式是____________________________
②决定氯乙烷能用于冷冻麻醉应急处理的具体性质是________(填选项)
| A.沸点低 | B.沸点高 | C.易挥发 | D.难挥发 |
(3)“可燃冰”是天然气与水相互作用形成的晶体物质,若把“可燃冰”(用甲烷表示)燃烧在一定条件下改装成原电池,则在原电池的负极发生反应的物质是