题目内容
(共10分)现有阳离子交换膜、阴离子交换膜、石墨电极,请用氯碱工业中的膜技术原理,回答下列问题。
(1)写出氯碱工业中电解饱和食盐水的离子方程式 ;
(2)请利用交换膜技术,根据上图框架,设计一个电解硫酸钠溶液制氢氧化钠溶液和硫酸溶液的装置,标出进出物质的化学式:
A_________;C_________; E_________;膜b为 离子交换膜(填“阳”或“阴”)。
(各2分,共10分)
(1)2Cl-+2H2O  2OH-+Cl2↑+H2↑;
2OH-+Cl2↑+H2↑;
(2) O2;NaOH;Na2SO4(溶液);阳
解析试题分析:(1)电解饱和食盐水生成氯气、氢气、氢氧化钠,
离子方程式为2Cl-+2H2O  2OH-+Cl2↑+H2↑;
2OH-+Cl2↑+H2↑;
(2)电解硫酸钠实际是电解水,要想得到氢氧化钠和硫酸,在阴极是氢氧根离子放电,所以氢氧根离子浓度增大,所以氢氧化钠应在阴极区得到,则膜b应是阳离子交换膜,只允许阳离子Na+通过,而氢氧根离子留在阴极区,从而得到氢氧化钠;阳极是氢离子氢氧根离子放电生成氧气,氢离子浓度相对增大,要想得到硫酸,则膜a应是阴离子交换膜,只允许阴离子通过,而氢离子留在阳极区,与硫酸根留在形成硫酸。所以A气体是O2,C是NaOH,E是Na2SO4(溶液);b是阳离子交换膜。
考点:考查电解原理的应用,离子交换膜的判断

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案原电池的正极和电解池的阴极所发生的反应分别是( )
| A.氧化、还原 | B.还原、氧化 |
| C.氧化、氧化 | D.还原、还原 |
某小组为研究电化学原理,设计如图装置,下列叙述正确的是( )
| A.若a和b为石墨,通电后a电极上发生的反应为Cu2++2e-=Cu |
| B.若a和b为铜,通电后a电极有气体产生 |
| C.若a为铜,b为铁,通电后Cu2+向a电极移动 |
| D.若a为粗铜,b为纯铜,通电后b电极质量增加 |
将纯锌片和纯铜片按图所示方式插入相同浓度的稀硫酸中,以下有关叙述中正确的是 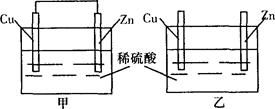
| A.甲装置中铜片表面有气泡生成 | B.乙装置中电能转化为化学能 |
| C.甲装置中电能转化为化学能 | D.乙装置中铜片表面有气泡生成 |
工业上电解制碱的技术是用阳离子交换膜法,主要原料是饱和食盐水。下图为阳离子交换膜法电解原理示意图:
请回答下列问题: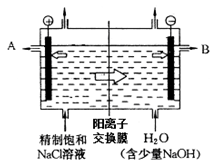
(1)A极为电解槽的________极,B极的材料工业上常采用的是生活中常见的金属,但有大量损耗,其主要原因是 。(填“吸氧腐蚀”或“析氢腐蚀”)
(2)电解槽中部的阳离子交换膜把电解槽隔成了阴极室和阳极室,这种阳离子交换膜,只允许溶液中的__________通过(填写下列微粒的编号)。
①H2,②Cl2,③H+,④Cl-,⑤Na+,⑥OH-。
(3)若上述电解过程中用阴离子交换膜代替阳离子交换膜(已知:3Cl2 +6OH-==5Cl-+ClO3-+3H2O),下列说法正确的组合是 。
| A.电解结束时,右侧溶液中含有ClO3— |
B.电解槽内发生反应的总化学方程式为:NaCl + 3H2O  NaClO3 + 3H2↑ NaClO3 + 3H2↑ |
| C.用阴离子交换膜后,电解槽内两个电极发生的电极反应与原来一样 |
| D.用阴离子交换膜后,阳离子的定向移动方向与原来相反 |
如图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加一滴石蕊试液,下列实验现象中正确的是( )
| A.逸出气体的体积a电极的小于b电极的 |
| B.一电极逸出无味气体,另一电极逸出刺激性气味气体 |
| C.a电极附近呈红色,b电极附近出现蓝色 |
| D.a电极附近呈蓝色,b电极附近出现红色 |
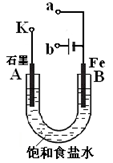
 4LiCl +S+SO2。
4LiCl +S+SO2。