题目内容
下图所示各种装置中能构成原电池的是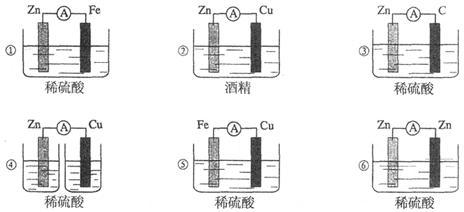
| A.①②③ | B.④⑤⑥ |
| C.①③⑤ | D.②④⑥ |
C
解析试题分析:原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应。原电池中正极上发生还原反应,负极上发生氧化反应,据此可知装置①③⑤是原电池。②中酒精是非电解质,不能构成原电池。④中没有形成闭合回路,不能构成原电池;⑥中电极相同,不能构成原电池,答案选C。
考点:考查原电池的判断
点评:该题是高考中的常见考点,属于基础性试题的考查,难度不大。明确原电池的工作原理、构成条件是答题的关键。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
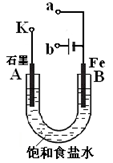
某小组为研究电化学原理,设计如图装置,下列叙述正确的是
| A.若a和b为石墨,通电后a电极上发生的反应为2Cl--2e-=Cl2↑ |
| B.若a和b为石墨,通电后b电极上发生氧化反应 |
| C.若a为铜,b为铁,通电后a电极质量增加 |
| D.若a为铜,b为铁,通电后Cu2+向铁电极移动 |
CO无色无味有毒,世界各国每年均有不少人因CO中毒而失去生命。一种CO分析仪的工作原理如右图所示,该装置中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法错误的是( )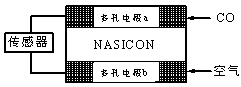
| A.负极的电极反应式为:CO+O2—―2e-=CO2 |
| B.工作时电极b作正极,O2-由电极a流向电极b |
| C.工作时电子由电极a通过传感器流向电极b |
| D.传感器中通过的电流越大,尾气中CO的含量越高 |
下列用来表示物质变化的化学用语中,正确的是( )
| A.钢铁发生电化学腐蚀的正极反应式为:Fe-2e-=Fe2+ |
| B.氢氧燃料电池的负极反应式为:O2+2H2O+4e-=4OH- |
| C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+ |
| D.电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑ |
原电池的正极和电解池的阴极所发生的反应分别是( )
| A.氧化、还原 | B.还原、氧化 |
| C.氧化、氧化 | D.还原、还原 |
某金属元素R的硝酸盐R(NO3)n溶液用Pt电极电解,阳极产生气体V L(标准状况)时,阴极质量增加m g,若R的原子量为M,下列叙述中不正确的是 ( )
A.电路中通过电子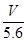 mol mol | B.n=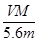 |
C.溶液中H+增加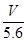 mol mol | D.n=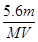 |
X、Y、Z三种金属,X、Y组成原电池,X是负极;把Y放在Z的硝酸银溶液中,Y表面有Z析出。其活泼顺序是
| A.X>Y>Z | B.Z>Y>X | C.X>Z>Y | D.Y>X>Z |
下列与金属腐蚀有关的说法,正确的是
| A.图1中,插入海水中的铁棒,越靠近底端腐蚀越严重 |
| B.图2中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现 |
| C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀 |
| D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极 |