题目内容
(12分)【化学——化学与技术】
海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
(1)多级闪蒸法是目前“海水淡化”的主要技术。该法是在一定条件下将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水。由此可判断多级闪蒸法是 (填“物理变化” 或“化学变化”)。
(2)利用海水晒盐的原理是 ;分离食盐晶体后的母液中含有KCl、MgCl2,经过分离、提纯后,可用于 。
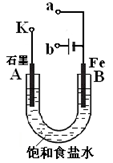
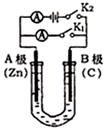
(3)“氯碱工业”利用电解饱和食盐水制得重要化工产品。在氯碱工业中,隔膜法电解(如图甲所示)工艺逐渐被离子交换膜电解(如图乙所示)技术取代。
①写出两电极的反应式:阳极 ,阴极 。
②石棉隔膜的作用是 。离子交换膜电解槽中⑥、⑦分别是 、 。
(1)物理变化(1分)
(2)蒸发、结晶 (1分) 工业上冶炼金属钾和镁(2分)
(3)①2Cl--2e-=Cl2↑(2分) 2H++2e- =H2↑(2分)
② 分成阴、阳两极室,阻止气体通过(2分) NaOH溶液(1分) Na+(1分)
解析试题分析:(1)海水变成蒸汽,蒸汽经过冷却而得高纯度淡水为物质状态的变化,没有生成新物质,所以多级闪蒸法是物理变化。
(2)食盐的溶解度受温度的影响小,从食盐溶液中获得食盐主要利用阳光和风蒸发水分,使氯化钠成晶体析出;分离食盐晶体后的母液中含有KCl、MgCl2,经过分离、提纯后,可用电解法冶炼金属钾和镁。
(3)①用惰性电极电解饱和食盐水时, Cl-的放电能力强于OH-,阳极氯离子失去电子,发生氧化反应,电极方程式为:2Cl--2e-═Cl2↑,阴极是氢离子放电生成氢气,阴极发生反应的电极方程式为:2H++2e-═H2↑
②如果Cl2和NaOH溶液接触,发生反应2NaOH+Cl2═NaClO+NaCl+H2O,为了防止Cl2和NaOH反应,石棉隔膜的作用是分成阴、阳两极室,阻止气体通过;电解饱和食盐水时电解槽离子膜,允许阳离子和水分子通过,不允许阴离子通过;阴极是氢离子放电生成氢气,同时生成氢氧化钠,所以⑥为氢氧化钠,⑦为Na+。
考点:本题考查海水的淡化、海水的利用、氯碱工业。

 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案X、Y、Z三种金属,X、Y组成原电池,X是负极;把Y放在Z的硝酸银溶液中,Y表面有Z析出。其活泼顺序是
| A.X>Y>Z | B.Z>Y>X | C.X>Z>Y | D.Y>X>Z |
 4LiCl +S+SO2。
4LiCl +S+SO2。

 2PbSO4+2H2O。
2PbSO4+2H2O。