题目内容
12.下列关于Na2O和Na2O2的叙述正确的是( )| A. | Na2O与Na2O2颜色相同 | |
| B. | Na2O和Na2O2都是碱性氧化物 | |
| C. | Na2O与Na2O2都能用于漂白,杀菌、消毒 | |
| D. | 阴阳离子的个数比均为1:2 |
分析 A、氧化钠是白色的,过氧化钠是黄色的固体;
B、碱性氧化物是指能与酸反应生成盐和水的金属氧化物;
C、Na2O无强氧化性;
D、Na2O2晶体中是O22-一个离子.
解答 解:A、氧化钠是白色的,但是过氧化钠是黄色的固体,故A错误;
B、因过氧化钠与酸反应生成盐、水和氧气,则过氧化钠不属于碱性氧化物,故B错误;
C、Na2O无强氧化性,则不能能用于漂白,杀菌、消毒,故C错误;
D、Na2O2晶体中是O22-一个离子,则Na2O和Na2O2中阴阳离子的个数比均为1:2,故D正确.
故选D.
点评 本题考查钠的氧化物,明确发生的化学反应及相关的概念是解答本题的关键,难度不大.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
3.下列说法错误的是( )
| A. | 蒸馏法分离混合物时,冷凝管下口进水,上口出水 | |
| B. | 分离CCl4和H2O的混合物时,CCl4从分液漏斗下口放出 | |
| C. | 蒸干NaCl溶液制NaCl晶体 | |
| D. | 不能用酒精萃取碘水中的I2 |
20.A、B、C、D、E五瓶透明溶液,分别是BaCl2、Na2CO3、NaHSO4、Ba(OH)2和NaHCO3溶液中的一种.为了鉴别,各取少量溶液进行两两混合,实验结果如下表所示.表中“↓”表
示生成沉淀或微溶化合物,“-”表示观察不到明显现象,“↑”表示有气体产生.
试回答下列问题:
(1)B是Ba(OH)2 C是NaHCO3 D是Na2CO3E是BaCl2(填化学式).
(2)写出下列离子反应方程式
①A与E反应的离子方程式:Ba2++SO42-=BaSO4↓;
②将B的溶液逐滴加入C的溶液中直至过量,在此过程中,所发生的离子反应可能有:Ba2++2OH-+2HCO3-=BaCO3↓+CO32-+2H2O,Ba2++CO32-=BaCO3↓;
③将等物质的量浓度、等体积的A、B两溶液混合Ba2++OH-+H++SO42-=BaSO4↓+H2O.
示生成沉淀或微溶化合物,“-”表示观察不到明显现象,“↑”表示有气体产生.
| A | B | C | D | E | |
| A | - | ↓ | ↑ | ↑ | ↓ |
| B | ↓ | - | ↓ | ↓ | - |
| C | ↑ | ↓ | - | - | - |
| D | ↑ | ↓ | - | - | ↓ |
| E | ↓ | - | - | ↓ | - |
(1)B是Ba(OH)2 C是NaHCO3 D是Na2CO3E是BaCl2(填化学式).
(2)写出下列离子反应方程式
①A与E反应的离子方程式:Ba2++SO42-=BaSO4↓;
②将B的溶液逐滴加入C的溶液中直至过量,在此过程中,所发生的离子反应可能有:Ba2++2OH-+2HCO3-=BaCO3↓+CO32-+2H2O,Ba2++CO32-=BaCO3↓;
③将等物质的量浓度、等体积的A、B两溶液混合Ba2++OH-+H++SO42-=BaSO4↓+H2O.
7.下列各种粒子,在氧化还原反应中通常只可作为氧化剂使用的是( )
| A. | SO32- | B. | MnO4- | C. | Cl- | D. | Fe |
17.锑(Sb)在自然界一般以硫化物的形式存在,我国锑的蕴藏量占世界第一.从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:①2Sb2S3+3O2+6Fe═Sb4O6+6FeS;②Sb4O6+6C═4Sb+6CO.下列说法正确的是( )
| A. | 反应②说明高温下Sb还原性比C强 | |
| B. | 反应①②中氧化剂分别是Sb2S3、Sb4O6 | |
| C. | 每生成1 mol Sb时,反应①与反应②中还原剂的物质的量之比为1:1 | |
| D. | 反应①中每生成1 mol FeS时,共转移2mol电子 |
16.下列有关化学用语中最能体现氮原子核外电子运动状态的是( )
| A. | 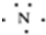 | B. |  | ||
| C. |  | D. | 1s22s22p3 |
