题目内容
【题目】将0.01mol的铁、铝混合物溶于100mL 0.2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示.当V1=16mL时,则V2为( ) 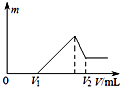
A.24mL
B.30mL
C.440mL
D.44mL
【答案】D
【解析】解:当V1=16mL时,此时,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,
由Na+离子守恒可知,n(Na2SO4)= ![]() n(Na+)=
n(Na+)= ![]() n(NaOH)=
n(NaOH)= ![]() ×0.016L×1mol/L=0.008mol,
×0.016L×1mol/L=0.008mol,
设MgSO4为xmol、Al2(SO4)3为ymol,则:
根据Mg原子、Al原子守恒有:x+2y=0.01,
100mL 0.2mol/L的H2SO4溶液中含有硫酸的物质的量为:0.2mol/L×0.1L=0.02mol,
根据SO42﹣离子守恒有:x+3y=0.02﹣0.008=0.012,
联立方程解得:x=0.006、y=0.002,
所以金属粉末中:n(Mg)=0.006mol,n(Al)=2y=2×0.02mol=0.004mol,
滴加NaOH溶液到体积V2时时,溶液是Na2SO4和NaAlO2混合液,根据SO42﹣离子、Na+离子和Al原子守恒有:
n(NaOH)=2n(Na2SO4)+n(NaAlO2)=2n(H2SO4)+n(Al)=2×0.02mol+0.004mol=0.044mol,
则V2= ![]() =0.044L=44mL,
=0.044L=44mL,
故选D.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案
相关题目