题目内容
【题目】某校化学小组学生利用如图所列装置进行“铁与水反应”的实验,并进行了其他有关实验.(图中夹持及尾气处理装置均已略去) 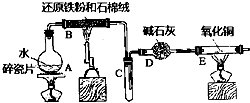
(1)装置B中发生反应的化学方程是
(2)装置E中的现象是
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤.
①欲检验溶液中含有Fe3+ , 选用的试剂为 , 现象是 .
②该实验小组同学用上述试剂没有检测到Fe3+ , 用离子方程式解释滤液中不存在Fe3+可能的原因: .
③在此溶液中加入少量酸性高锰酸钾溶液,高锰酸钾褪色,溶液中反应的离子方程式 .
【答案】
(1)3Fe+4H2O(g) ![]() Fe3O4+4H2
Fe3O4+4H2
(2)黑色氧化铜变红,玻璃管右端出现无色液滴
(3)硫氰化钾(KSCN);溶液变红;2Fe3++Fe=3Fe2+;5Fe2++MnO4﹣+8H+=5Fe3++Mn2++4H2O
【解析】解:(1)装置B中发生反应的化学方程是3Fe+4H2O(g) ![]() Fe3O4+4H2 , 所以答案是:3Fe+4H2O(g)
Fe3O4+4H2 , 所以答案是:3Fe+4H2O(g) ![]() Fe3O4+4H2;(2)E中氢气还原CuO生成Cu、水,则观察到的现象为黑色氧化铜变红,玻璃管右端出现无色液滴,所以答案是:黑色氧化铜变红,玻璃管右端出现无色液滴;(3)①欲检验溶液中含有Fe3+ , 选用的试剂为硫氰化钾(KSCN),现象是溶液变红,所以答案是:硫氰化钾(KSCN);溶液变红;
Fe3O4+4H2;(2)E中氢气还原CuO生成Cu、水,则观察到的现象为黑色氧化铜变红,玻璃管右端出现无色液滴,所以答案是:黑色氧化铜变红,玻璃管右端出现无色液滴;(3)①欲检验溶液中含有Fe3+ , 选用的试剂为硫氰化钾(KSCN),现象是溶液变红,所以答案是:硫氰化钾(KSCN);溶液变红;
②该实验小组同学用上述试剂没有检测到Fe3+ , 用离子方程式解释滤液中不存在Fe3+可能的原因为2Fe3++Fe=3Fe2+ , 所以答案是:2Fe3++Fe=3Fe2+;
③在此溶液中加入少量酸性高锰酸钾溶液,高锰酸钾褪色,亚铁离子具有还原性,溶液中反应的离子方程式为5Fe2++MnO4﹣+8H+=5Fe3++Mn2++4H2O,
所以答案是:5Fe2++MnO4﹣+8H+=5Fe3++Mn2++4H2O.

【题目】下列各工业生产中,石灰石、生石灰、熟石灰都不能作为原料的是( )
①炼铁 ②用生铁炼钢 ③从海水中提取镁 ④铝的冶炼 ⑤制水泥 ⑥制玻璃 ⑦制漂白粉 ⑧制硫酸
A.④⑧
B.⑤⑥
C.①②③
D.⑤⑥⑦
【题目】化学工业与人类的生产生活息息相关,回答下列问题:
已知反应: Fe(s)+CO2(g) ![]() FeO(s)+CO(g) △H =a kJmol-1,测得在不同温度下,平衡常数 K 值如下:
FeO(s)+CO(g) △H =a kJmol-1,测得在不同温度下,平衡常数 K 值如下:
温度/℃ | 500 | 700 | 900 |
K | 1.00 | 1.47 | 2.40 |
(1)写出 K 的表达式__________________。
(2)反应中的 a____________0(填“>”、“<”或“=”)。
(3)若 500℃时进行反应,CO2 起始浓度为 3molL-1,CO 的平衡浓度为______molL-1。
(4)700 ℃时反应达到平衡,要使该平衡向右移动且能增大 CO2(g)的转化率,其他条件不变时,可以采取的措施有________(填序号)。
A.升高温度到 900 ℃ B.通入 CO2
C.增加 Fe 的量 D.使用合适的催化剂
(5)700℃反应达到平衡,此时增大反应中 CO 的浓度,该平衡移动后达到新的平衡,其它条件不变时,CO 和 CO2 的体积比值__________(填“增大”、“减小”或 “不变”)。
