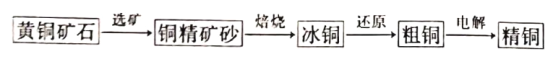
题目内容
【题目】某温度下,H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数K=9/4。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。下列判断不正确的是
H2O(g)+CO(g)的平衡常数K=9/4。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。下列判断不正确的是
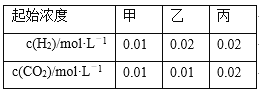
A. 反应开始时,丙中的反应速率最快,甲中的反应速率最慢
B. 平衡时,甲中和丙中H2的转化率均是60%
C. 平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol·L-1
D. 平衡时,乙中CO2的转化率大于60%
【答案】C
【解析】
A、反应开始时,丙中的物质的浓度最大,反应速率最快,甲中的物质的浓度最小,反应速率最慢,选项A正确;
B、甲和丙对比,相当于是在甲的基础上又加倍增大了物质的加入量,但是对于化学反应前后体积不变的反应,增大压强,化学平衡不移动,物质的转化率不变,根据计算得出甲中H2的转化率是60%,所以丙中H2的转化率是60%,选项B正确;
C、对于甲容器:H2(g)+CO2(g)![]() H2O(g)+CO(g)
H2O(g)+CO(g)
开始(mol/L): 0.01 0.01 0 0
变化(mol/L): x x x x
平衡(mol/L): 0.01-x 0.01-x x x
所以![]() =
=![]() ,解得x=0.006,c(CO2)=0.01mol-0.006mol=0.004mol;甲和丙对比,相当于是在甲的基础上又加倍增大了物质的加入量,但是对于化学反应前后体积不变的反应,增大压强,化学平衡不移动,丙的初始投入量是甲的2倍,所以平衡时,丙中c(CO2)是甲中的2倍,但为0.008mol,选项C不正确;C、乙和甲对比,乙相当于在甲的基础上增加了氢气的量,所以乙中二氧化碳的转化率增大,会大于甲中的,即大于60%,选项D正确。答案选C。
,解得x=0.006,c(CO2)=0.01mol-0.006mol=0.004mol;甲和丙对比,相当于是在甲的基础上又加倍增大了物质的加入量,但是对于化学反应前后体积不变的反应,增大压强,化学平衡不移动,丙的初始投入量是甲的2倍,所以平衡时,丙中c(CO2)是甲中的2倍,但为0.008mol,选项C不正确;C、乙和甲对比,乙相当于在甲的基础上增加了氢气的量,所以乙中二氧化碳的转化率增大,会大于甲中的,即大于60%,选项D正确。答案选C。

 期末集结号系列答案
期末集结号系列答案【题目】Ⅰ.根据下表左边的“实验操作”,从右边的“实验现象”中选择正确的字母代号,填入对应“答案”的空格中。
实验操作 | 答案 | 实验现象 |
(1)让一束光线通过Fe(OH)3胶体 | ______ | A.呈蓝色 B.生成白色胶状沉淀 C.呈现光亮“通路” D.产生红褐色沉淀 |
(2)向盛有FeCl3溶液的试管中加入NaOH溶液 | ______ | |
(3)向Al2(SO4)3溶液中滴加氨水 | ______ | |
(4)向土豆片上滴加碘水 | ______ |
Ⅱ.某校化学兴趣小组,通过下列装置探究Na2CO3和NaHCO3的热稳定性,设计如下的探究方案,请你参与并完成该探究方案。
(1)提出假设:Na2CO3或NaHCO3加热分解时可能有CO2生成。
(2)设计实验:①利用下图装置分别对一定量的Na2CO3和NaHCO3进行加热;②为了检验CO2的生成,试管B中应加入的物质是_____________。

(3)现象与结论:同学们发现只有在加热NaHCO3时,试管B中才有气泡产生且有_______________沉淀生成(填沉淀的颜色),说明Na2CO3和NaHCO3的热稳定性是:Na2CO3_______ NaHCO3(填“>”或“<”)。
(4)某同学在探究NaHCO3的热稳定性时,称取了8.4gNaHCO3,充分加热,请你计算理论上可产生CO2气体的体积为__________L(标准状况)。