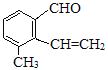
题目内容
【题目】下列有关化学反应的叙述正确的是( )
A.SO2与Ba(NO3)2反应生成BaSO3
B.NH3在纯O2中燃烧生成NO2
C.过量CO2与氨水反应生成NH4HCO3
D.高温条件下Fe与水蒸气反应生成Fe(OH)3和H2
【答案】C
【解析】
A.二者发生反应生成硫酸钡沉淀,化学方程式为3SO2+Ba(NO3)2+2H2O=BaSO4↓+2NO↑+2H2SO4,A错误;
B.氨气在纯氧中燃烧生成氮气和水,化学方程式为4NH3+3O2=2N2+6H2O,B错误;
C.过量CO2通入到氨水时生成NH4HCO3,化学方程式为2NH3+CO2+H2O =2NH4HCO3,C正确;
D.高温条件下Fe与水蒸气反应生成四氧化三铁和氢气,化学方程式为3Fe+4H2O(g)![]() Fe3O4+4H2,D错误;
Fe3O4+4H2,D错误;
故选C。

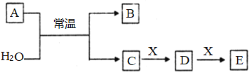
【题目】用生产钛白的副产品FeSO4与软锰矿(主要成分是MnO2)可制备高纯MnO2
(1)步骤①中研磨的目的是______________________。
(2)步骤②中主要发生的反应是FeSO4与MnO2转化为MnSO4与__________。
(3)步骤②中Mn2+浸出率受初始H2SO4浓度与温度的影响如下图所示。
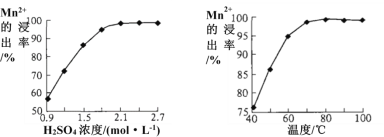
软锰矿粉酸浸的适宜条件是________________。
(4)步骤②中,若硫酸初始浓度小于1.8mol/L,反应进行一段时间后,有红褐色固体析出,其原因是____________。
(5)已知MnSO4粗液中还含有Al3+、Fe3+和Ni2+离子,溶液中离子生成氢氧化物的pH如下表:
Al(OH)3 | Fe(OH)3 | Ni(OH)2 | Mn(OH)2 | |
开始沉淀时pH | 3.4 | 1.5 | 6.9 | 8.2 |
完全沉淀时pH | 4.7 | 2.8 | 8.9 | 10.2 |
注:金属离子的起始浓度为0.1mol·L-1
步骤③进行的操作是:调节pH=5.4,过滤,滤渣中含_____________________。
(6)已知:几种难溶物的溶解平衡常数K
化学式 | MnCO3 | NiCO3 | MnS | NiS |
K | 2.24×10-11 | 1.42×10-7 | 4.65×10-14 | 1.07×10-21 |
步骤③还需加入的除杂试剂是_______固体(填序号)。
A.Na2CO3 B.MnCO3 C.Na2S D.MnS
(7)步骤⑤中焙烧MnCO3制MnO2,发生反应的化学方程式是_____________。
【题目】合成气的主要组分为CO和H2;以天然气为原料生产的合成气有多种方法,其中Sparg工艺的原理为CH4(g)+CO2(g)2CO(g)+2H2(g)。在特定温度下,向甲、乙、丙三个密闭容器中充入相同量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如下表所示:
实验编号 | 容器温度/℃ | 容器体积 | 物质浓度/(mol·L-1) | ||
CH4 | CO2 | CO | |||
甲 | 300 | V1 | 0.02 | 0.02 | 0.10 |
乙 | 300 | V2 | x | x | 0.05 |
丙 | 350 | V1 | y | y | 0.12 |
下列说法正确的是( )
A.该反应在低温条件下不能自发进行
B.300 ℃时反应的平衡常数为25
C.V1∶V2=3∶7
D.保持温度和容器体积不变,开始时向甲容器中充入0.28 mol CO和0.28 mol H2,CO转化率一定大于2/7