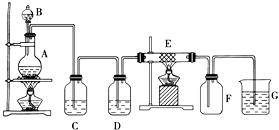
题目内容
【题目】如图Ⅰ、Ⅱ、Ⅲ是常见的气体发生装置;V、VI是气体收集装置,根据要求回求答下列问题: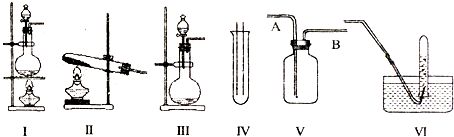
(1)气体发生装置的选择:若用CaCO3与盐酸反应制CO2 , 则可选择;(填序号)若用I装置制取氯气,则浓盐酸应盛放在(填I中的仪器名称).写出实验室制取氯气的化学方程式 .
(2)收集装置的选择:若选用V为氯气收集装置,则氯气应从口通入.用化学方法检验氯气收集满的方法是 .
(3)实验室制取氯气,多余的氯气要进行尾气处理,一般将尾气通入到溶液中,其发生反应的化学方程式为 .
(4)气体的吸收:若经试验发现,现1体积的水已吸收336体积的HCl,且得到的溶液的密度为1.08g/cm3 , 则所得溶液中溶质的物质的量浓度为mol/L.(保留一位小数)
【答案】
(1)Ⅲ,分液漏斗,MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)A,将湿润的淀粉KI试纸放在B口处,试纸变蓝色,证明氯气已集满
(3)NaOH溶液,2NaOH+Cl2=NaCl+NaClO+H2O
(4)10.5
【解析】解:(1)若用CaCO3与盐酸反应制CO2,为固体和液体的反应,常温下可进行,可选择Ⅲ装置,用I装置制取氯气,浓盐酸放在分液漏斗中,浓盐酸和二氧化锰在加热条件下反应生成氯气、氯化锰和水,反应的方程式为:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)氯气的密度大于空气的密度,所以应采用向上排空气法收集氯气,故A为进气口;氯气的氧化性大于碘的氧化性,所以氯气能置换出碘化钾中的碘,且碘遇淀粉变蓝色,所以可用湿润的淀粉KI试纸检验是否收集满了氯气.
(3)氯气有毒,逸出会污染大气,所以不能让氯气逸出;氯气和水能反应是盐酸和次氯酸,盐酸和次氯酸是酸,都能和碱反应,所以可用氢氧化钠溶液吸收氯气;
(4)1体积的水已吸收336体积的HCl,可设水的体积为1L,HCl的体积为336L,则标准状况下336L HCl的物质的量为: ![]() =15mol,质量为m=nM=36.5g/mol×15mol=547.5g,则所得盐酸溶液中溶质的质量分数为w=
=15mol,质量为m=nM=36.5g/mol×15mol=547.5g,则所得盐酸溶液中溶质的质量分数为w= ![]() ×100%≈35.4%,
×100%≈35.4%,
溶质的物质的量浓度为:c= ![]() mol/L≈10.5mol/L,
mol/L≈10.5mol/L,
所以答案是:(1)Ⅲ;分液漏斗;MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;(2)A;将湿润的淀粉KI试纸放在B口处,试纸变蓝色,证明氯气已集满;(3)NaOH溶液;2NaOH+Cl2=NaCl+NaClO+H2O;(4)10.5
MnCl2+Cl2↑+2H2O;(2)A;将湿润的淀粉KI试纸放在B口处,试纸变蓝色,证明氯气已集满;(3)NaOH溶液;2NaOH+Cl2=NaCl+NaClO+H2O;(4)10.5