题目内容
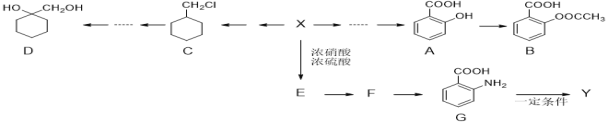
【题目】已知和碳元素同主族的X元素位于元素周期表中的第一个长周期,短周期元素Y原子的最外层电子数比内层电子总数少3,它们形成化合物的分子式是XY4。试回答:
(1)X元素的原子基态时电子排布式为:___________________________________,Y元素原子最外层电子的电子排布图为:____________。
(2)若X、Y两元素电负性分别为2.1和2.85,试判断XY4中X与Y之间的化学键为________(填“共价键”或“离子键”)。
(3)该化合物的空间结构为______________形,中心原子的轨道杂化类型为__________,分子为______________(填“极性分子”或“非极性分子”)。
(4)该化合物在常温下为液体,该液体微粒间的作用力是____________。
(5)该化合物的沸点与SiCl4比较:________(填化学式)的高,原因是_________________________。
【答案】1s22s22p63s23p63d104s24p2 ![]() 共价键 正四面体 sp3杂化 非极性分子 范德华力 GeCl4 组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越大,熔、沸点越高
共价键 正四面体 sp3杂化 非极性分子 范德华力 GeCl4 组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越大,熔、沸点越高
【解析】
X元素与碳元素同主族且位于周期表中的第一长周期,X为Ge元素,Y原子是短周期元素且最外层电子数比内层电子总数少3,Y为Cl元素,化合物XY4为GeCl4。
(1)Ge元素是32号元素,基态原子核外电子排布式为 [Ar] 3d104s24p2或1s22s22p63s23p63d104s24p2;氯元素原子最外层电子的电子排布图为![]() ;
;
(2)Cl元素与Ge元素的电负性差为2.85-2.1=0.75,小于1.7,所以GeCl4为共价化合物,分子内只含有共价键;
(3)Ge元素与C元素处于相同主族,GeCl4与CCl4 具有相似的结构和性质,Ge原子采取sp3杂化,GeCl4为正四面体形,空间对称,是非极性分子;
(4)GeCl4在常温下为液体,熔点低,由分子构成.微粒间作用力为范德华力;
(5)这两种化合物的结构相似,GeCl4相对分子质量大,分子间作用力强,沸点高。

 名校课堂系列答案
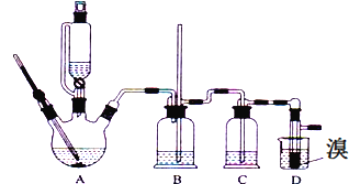
名校课堂系列答案【题目】实验室用少量的溴和足量的乙醇、浓硫酸制备1,2﹣二溴乙烷的装置如下图所示,其中可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。有关数据列表如下:
乙醇 | 1,2﹣二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm﹣3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -l30 | 9 | -1l6 |
回答下列问题:
(1)用少量的溴和足量的乙醇、浓硫酸制备1,2﹣二溴乙烷的需分两步进行,第二步反应的化学方程式为_______________
(2)在此实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是_______(填正确选项前的字母)。
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(3)在装置C中应加入_______,其目的是吸收反应中可能生成的酸性气体(填正确选项前的字母)。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)将1,2﹣二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在________层(填“上”、“下”)。
(5)若产物中有少量未反应的Br2,最好用__________洗涤除去(填选项前字母)。
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用__________的方法除去。
(7)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是_____________________